Tumor biology
The vast majority of tumors, with a few exceptions, are of monoclonal origin, i.e. all tumor cells originate from a single cell that was initially healthy due to mitotic events.
The first evidence was obtained through the following technique: an enzyme, glucose-6-phosphate dehydrogenase (G6PD) encoded by a gene on the X chromosome, an enzyme of which there are several isoforms, each encoded by a different allele. It was noted that following the phenomenon of lyonization (inactivation of the X chromosome) one of the two X chromosomes went into gene silencing for most of its genes, randomly and during the early stages of embryonic development. In heterozygosity, depending on which allele is silenced, one or the other enzymatic isoform of G6PD will be expressed, so a monoclonal tumor should have all cells with the same silenced X chromosome, depending on a single cell of origin. A polyclonal tumor would be a mix of cells with one or the other silenced X chromosome.
For example, benign tumors of the cervix of several patients were taken, and the type of isoform expressed by the cells of the tumor was analyzed by electrophoresis, and since all the cells of the same tumor expressed the same isoform, and never both isoforms at the same time, it was realized to have to do with monoclonal tumors.
As said, therefore, all tumors, benign and malignant, with a few rare exceptions, are of monoclonal origin, so there will be a first cell that will undergo a series of gene alterations and will give rise to a neoplastic population.
In fact, a tumor is born from a population of healthy cells, one of which may undergo a mutation, which may be induced by chance by a chemical carcinogen, etc.. but in any case, whatever the cause, a mutation is never sufficient to cause a tumor (many genes relevant to the tumor must be altered for this to occur). This first mutation may be favourable to the cell (thus triggering a Darwinian selection mechanism), for example it may favour its proliferation, and in this way a population of mutated daughter cells will be created.
The mutation must have the following characteristics
-Not lethal
-Don't get repaired
-be a relevant mutation for cancer, e.g. touching genes important for tumor growth.
Within this population there may then be a second favourable mutation in addition to the first. In the table the concept of monoclonality is maintained, because each cell originates from the first mutated cell, and this mutation is present in all cells.
Starting from the first cell, therefore, we do not have a linear but branched progression: it can happen, for example, that a cell meets a new mutation, giving rise to a cell subclone that, while maintaining the starting mutations, also presents the new mutation. In fact in any tumor the cells of parenchyma are not all the same: they have one or more mutations in common, but they are not identical. We speak of subclones, subpopulations with different characteristics and mutations, originating however from a single cell, the one that carries the initial mutation.
In the case of a further mutation, this can be unfavorable and cause the cell to die, another mutation can be irrelevant or bring the cell into G0 forever: in all these cases a tumor will not be formed. Continuing with the different mutations we will have an evolutionary progression, with a series of mutations that must give the cells a selective advantage, that is the acquisition by the cells of tumor characteristics (autonomy, immortality...).
These subclones are in conflict with each other (Darwinian competition): some are at an advantage over others precisely because of the different mutations, and over time some of them may predominate over others and at different moments in the life of the tumor some subclones may be more present than others.
This means that the cellular composition of the tumor parenchyma is extremely heterogeneous, made up of subclones that have their own biological characteristics.
Consequently the therapy is also difficult: some subclones may be sensitive to a drug, while others are not, in this case with the use of the drug the tumor initially reduces, but then increases due to the resistant subclones, so the new tissue that will be generated will be the result of the clones resistant to that drug and will be even more difficult to attack.
In a tumor, the mitotic index (percentage of cells in mitosis at the time the tumor was diagnosed) is low (varies between 3-15% depending on the type of tumor), so only a small proportion of tumor cells are proliferating at a given time. Most cells do not proliferate and probably never will. So it is not at all true that all cells in a tumor proliferate: there is only a fraction of proliferating cells.
Nor is it true that tumor cells proliferate rapidly: the duration of mitosis, in fact, varies depending on the tumor (12-24 hours) and is equal to that of other cells in our body (the same time to complete the cell cycle); indeed, some cells, such as embryonic cells and hematopoietic tissue, proliferate much more rapidly.
Considering therefore that the mitotic index is about 3-15%, and that the duration of the cell cycle is 2-4 days, the theoretical doubling time of a tumor should be 1-3 weeks, therefore much faster than what happens in reality. This discrepancy is due to the fact that growth in the tumor is slowed down by the extremely high cell mortality rate (70-90% of the cells produced), which means that not only do not all tumor cells proliferate and not excessively fast, but a large part of the tumor cells die and do not contribute to proliferation.
The growth of the tumor is therefore determined by the loss of the dynamic (homeostatic) balance between entry (cells that proliferate) and exit (cells that die), as happens under physiological conditions.
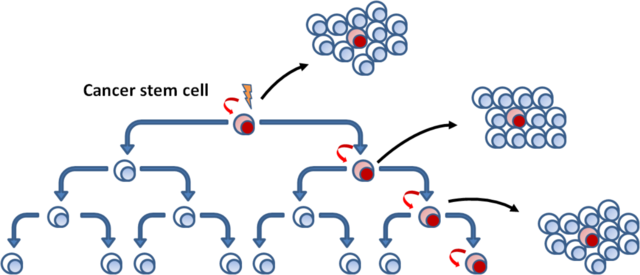
In healthy tissues there are stem cells (CS) and these have proliferative capacity: thanks to a mitosis they generate two daughter cells, one identical to the mother (stem) cell and a proliferative progenitor cell.
Cancer stem cells (TSCs) have been identified in the neoplastic tissue.
Healthy and tumor stem cells are distinguished from other cells by the presence of surface antigens, therefore using special markers that can be distinguished from the rest of the cells in a tissue.
Each tumor cell is characterized by the expression of two surface antigens: CD44 and CD24. Cells that express high levels of CD44 and low levels of CD24 correspond to tumor stem cells and, if injected into a guinea pig even in small amounts, they can give rise to a tumor; those that instead express high levels of both antigens, numerically higher, are the progenitor cells and, in the guinea pig, are able to induce a tumor only if injected in large quantities.
Healthy stem cells, if injected into a new host, are able to recreate the tissue from scratch: in the same way, TSCs are able to recreate tumor tissue; progenitor cells, on the other hand, have lost their stamina and are not able to recreate the tumor.
In the various types of tumor there are therefore cells with stem potential characterized by particular surface antigens, but each type of tumor has different markers and therefore there is not a single antigen of tumor cell staminality.
The cell of origin of the tumor may be a mutated stem cell, but it is not always so: in fact, it may happen that a progenitor cell undergoes mutations such as to regain stamina, to become a stem cell again, which then obviously will have to undergo many other mutations to give rise to the tumor. Moreover, there are many more progenitor cells than stem cells, so it is possible that one of them will be altered and go back to being a CS.
This concept has been understood by studying two cases of haematological tumors:
In chronic myeloid leukemia, the tumor stem cell is derived from a healthy hematopoietic stem cell that has mutated. This is the simplest case.
In acute leukaemia, on the other hand, the STC is derived from a progenitor cell that has mutated.
In a tumor, therefore, everything starts from a tumor stem cell, which will give rise to the progenitor cells that make up most of the tumor mass and almost all of the proliferating cells in the mitotic index. These progenitor cells will then tend to leave the cell cycle, and to differentiate within the limits imposed by neoplastic transformation (malignant tumors are poorly differentiated).
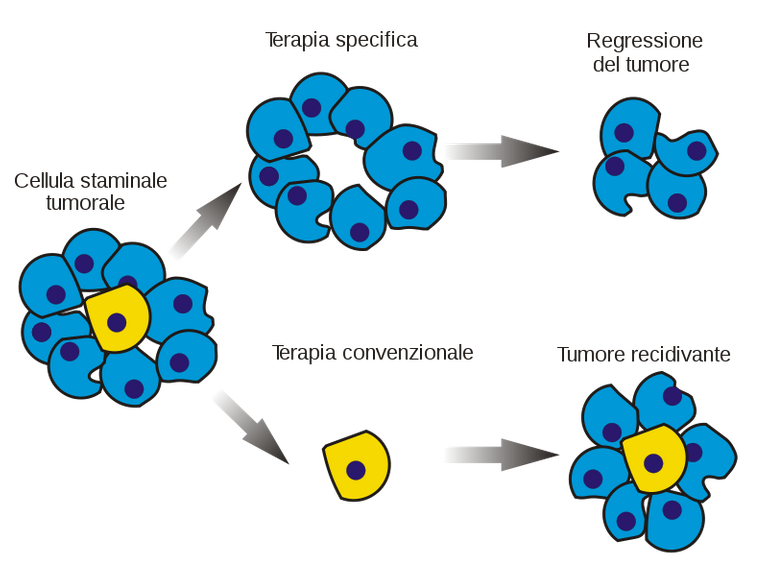
SSCs proliferate little and are drug-resistant as well as normal SSCs: all this has a deep therapeutic implication, because not only the tumor is composed of different subclones with different cell populations that may be differently susceptible to radio and chemotherapy (which act on proliferating cells, therefore especially on the progenitors), but also because SSCs, as well as healthy stem cells, proliferate little and have an efficient expulsion system and drug resistance.
In order to definitively eliminate a tumour, it is therefore necessary to destroy the SSCs: in fact, if we eliminate the tumour cells with a drug but leave the SSCs, these, as in the previous case of the guinea pig, are able to recreate the tumour and even if we eliminate only some subclones of the SSCs, those resistant to the drug, which therefore survive, they will give rise to a new tumour (recurrence) different from the initial tumour, because it is composed of the remaining subclones and not of all those present in the initial tumour.
Biologia tumorale
La stragrande maggioranza dei tumori, tranne qualche eccezione è di origine monoclonale, ossia tutte le cellule del tumore originano per eventi mitotici da un’unica cellula che inizialmente era sana.
Le prima evidenza si ebbe tramite la seguente tecnica: si sfruttò un enzima, la glucosio-6-fosfato deidrogenasi (G6PD) codificato da un gene posto sul cromosoma X, enzima del quale esistono diverse isoforme, ognuna codificata da un allele diverso. Si notò che in seguito al fenomeno della lyonizzazione (inattivazione cromosoma X) uno dei due cromosomi X andava incontro a silenziamento genico per la maggior parte dei suoi geni, in maniera casuale e durante le prime fasi dello sviluppo embrionale. In eterozigosi, a seconda di quale allele è silenziato, verrà espressa l’una o l’altra isoforma enzimatica del G6PD, quindi un tumore monoclonale dovrebbe avere tutte le cellule con lo stesso cromosoma X silenziato, dipendendo da un’unica cellula d’origine. Un tumore policlonale invece sarebbe un mix di cellule con uno o l’altro cromosoma X silenziato.
Ad esempio sono stati prelevati tumori benigni del collo dell’utero di diverse pazienti, e si è andati ad analizzare tramite elettroforesi il tipo di isoforma espressa dalle cellule del tumore, e poiché tutte le cellule dello stesso tumore esprimevano la stessa isoforma, e mai entrambe le isoforme contemporaneamente, si è capito di avere a che fare con tumori monoclonali.

Come detto quindi tutti i tumori, benigni e maligni, a parte qualche rara eccezione, sono di origine monoclonale, quindi esisterà una prima cellula che andrà incontro ad una serie di alterazioni geniche e darà origine ad una popolazione neoplastica.
Un tumore infatti nasce a partire da una popolazione di cellule sane, una delle quali potrà andare incontro ad una mutazione, la quale può essere indotta casualmente da un cancerogeno chimico, ecc. ma ad ogni modo, quale che sia la causa, una mutazione non è mai sufficiente a causare un tumore (devono essere alterati numerosi geni rilevanti per il tumore perché questo possa insorgere). Questa prima mutazione può essere favorevole alla cellula (innesca perciò un meccanismo di selezione darwiniana), ad esempio può favorire la sua proliferazione, e in questo modo si andrà a creare una popolazione di cellule figlie mutate.
La mutazione deve avere le seguenti caratteristiche:
-Non essere letale
-Non venire riparata dai meccanismi di riparazione
-Essere una mutazione rilevante per il cancro, ad es. toccando geni importanti per la crescita tumorale.
All’interno di questa popolazione può poi esserci una seconda mutazione favorevole che si aggiunge alla prima. Nella tabella viene mantenuto il concetto di monoclonalità, perché ciascuna cellula origina dalla prima cellula mutata, e tale mutazione è presente in tutte le cellule.
Partendo dalla prima cellula quindi non abbiamo una progressione lineare ma ramificata: può accadere per esempio che una cellula vada incontro ad una nuova mutazione, dando origine ad un subclone cellulare che, pur mantenendo le mutazioni di partenza, presenta anche la nuova mutazione. Infatti in qualsiasi tumore le cellule del parenchima non sono tutte uguali: hanno una o più mutazioni in comune, ma non sono identiche. Si parla di subcloni, sottopopolazioni con caratteristiche e mutazioni diverse, originanti comunque da un’unica cellula, quella che porta la mutazione iniziale.
Nel caso di un’ulteriore mutazione, questa può essere sfavorevole e far sì che la cellula muoia, un’altra mutazione può essere irrilevante o portare la cellula in G0 per sempre: in tutti questi casi non si formerà un tumore. Continuando via via con le diverse mutazioni avremo una progressione evolutiva, con una serie di mutazioni che devono conferire alle cellule un vantaggio selettivo, ossia l’acquisizione da parte delle cellule di caratteristiche tumorali (autonomia, immortalità…).
Questi subcloni sono in conflitto tra loro (competizione darwiniana): alcuni sono avvantaggiati rispetto ad altri proprio a causa delle diverse mutazioni, e col tempo alcuni di essi possono predominare su altri e in momenti diversi della vita del tumore alcuni subcloni possono essere più presenti rispetto ad altri.
Ciò comporta che la composizione cellulare del parenchima tumorale sia estremamente eterogenea, costituita da subcloni che hanno le proprie caratteristiche biologiche
Di conseguenza anche la terapia è difficoltosa: alcuni subcloni possono essere sensibili ad un farmaco, mentre altri non lo sono, in questo caso con l’utilizzo del farmaco il tumore inizialmente si riduce, ma successivamente aumenta a causa dei subcloni resistenti, quindi il nuovo tessuto che si verrà a generare sarà la risultante dei cloni resistenti a quel farmaco e sarà ancora più difficile da aggredire
In un tumore l’indice mitotico (percentuale di cellule in mitosi nel momento in cui il tumore è stato diagnosticato) è basso (varia tra il 3-15% a seconda del tipo di tumore), quindi solo una piccola parte delle cellule tumorali sta proliferando in un dato momento. La maggior parte delle cellule non prolifera e probabilmente non lo farà mai. Non è affatto vero dunque che tutte le cellule in un tumore proliferano: c’è solo una frazione di cellule proliferanti.
Non è vero neppure che le cellule tumorali proliferano rapidamente: la durata della mitosi, infatti, varia a seconda del tumore (12-24 ore) ed è uguale a quella delle altre cellule del nostro organismo (stesso tempo per compiere il ciclo cellulare); anzi, alcune cellule, come quelle embrionali e del tessuto ematopoietico, proliferano molto più rapidamente.
Considerando quindi che l’indice mitotico è di circa 3-15%, e che la durata del ciclo cellulare è di 2-4 giorni, il tempo di raddoppiamento teorico di un tumore dovrebbe essere di 1-3 settimane, quindi molto più veloce rispetto a quello che succede nella realtà. Questa discrepanza è data dal fatto che nel tumore la crescita è rallentata dal tasso di mortalità cellulare che è estremamente elevato (70-90% delle cellule prodotte); questo significa che, non solo non tutte le cellule tumorali proliferano e per di più in modo non eccessivamente rapido, ma un grossa parte delle cellule tumorali muore e non contribuisce alla proliferazione.
La crescita del tumore quindi è determinata dalla perdita dell’equilibrio dinamico (omeostatico) tra l’entrata (cellule che proliferano) e l’uscita (cellule che muoiono), come avviene invece in condizioni fisiologiche.

Nei tessuti sani esistono cellule staminali (CS) e queste hanno capacità proliferativa: grazie ad una mitosi generano due cellule figlie, una identica alla cellula madre (staminale) e una cellula progenitrice che prolifera.
Nel tessuto neoplastico sono state identificate le cellule staminali tumorali (CST).
Le cellule staminali sane e tumorali si distinguono dalle altre cellule per la presenza di antigeni di superficie, perciò utilizzando appositi marcatori che si possono distinguere dal resto delle cellule di un tessuto.
Ciascuna cellula tumorale è caratterizzata dall’espressione di due antigeni di superficie: CD44 e CD24. Le cellule che esprimono alti livelli di CD44 e bassi livelli di CD24 corrispondono alle cellule staminali tumorali e, se iniettate in una cavia anche in minima quantità, esse possono dare origine ad un tumore; quelle che invece esprimono alti livelli di entrambi gli antigeni, numeralmente maggiori, invece sono le cellule progenitrici e, nella cavia, sono in grado di indurre un tumore solamente se iniettate in grandissima quantità.
Le cellule staminali sane, se iniettate in un nuovo ospite, sono in grado di ricreare il tessuto ex novo: allo stesso modo le CST sono in grado di ricreare il tessuto tumorale; le cellule progenitrici invece hanno perso la staminalità e non sono in grado di ricreare il tumore.
Nei vari tipi di tumore ci sono quindi cellule con potenziale staminalità caratterizzate da particolari antigeni di superficie, ma ogni tipo di tumore presenta marcatori diversi e non esiste quindi un unico antigene della staminalità delle cellule tumorali.
La cellula di origine del tumore può essere una cellula staminale mutata, ma non è sempre così: può infatti accadere che una cellula progenitrice vada incontro a mutazioni tali da riacquisire la staminalità, da ritornare quindi ad essere una cellula staminale, che poi ovviamente dovrà andare incontro a molte altre mutazioni per dare origine al tumore. Oltretutto vi sono molte più cellule progenitrici rispetto alle cellule staminali, quindi è possibile che una di esse venga alterata e torni ad essere una CS.
Questo concetto è stato compreso studiando due casi di tumori ematologici:
In una leucemia mieloide cronica la cellula staminale tumorale deriva da una cellula staminale ematopoietica sana che è mutata. È il caso più semplice.
Nella leucemia acuta invece la CST deriva da una cellula progenitrice che è mutata.
In un tumore quindi tutto inizia da una cellula staminale tumorale, che darà origine alle cellule progenitrici che costituiscono la maggior parte della massa tumorale e la quasi totalità delle cellule proliferanti nell’indice mitotico. Queste cellule progenitrici tenderanno poi ad uscire dal ciclo cellulare, e a differenziare nei limiti imposti dalla trasformazione neoplastica (i tumori maligni sono poco differenziati).
Le CST proliferano poco e sono farmacoresistenti così come le CS normali: tutto questo ha una profonda implicazione dal punto di vista terapeutico, perché non solo il tumore è composto da subcloni diversi con popolazioni cellulari che possono essere suscettibili in modo diverso alla radio e alla chemioterapia (che agiscono sulle cellule in proliferazione, quindi soprattutto sui progenitori), ma anche perché le CST, così come le cellule staminali sane, proliferano poco e hanno un efficiente sistema di espulsione e di resistenza ai farmaci.
Per eliminare definitivamente un tumore è necessario quindi distruggere le CST: infatti se noi eliminiamo con un farmaco le cellule tumorali lasciando però le CST, queste, come nel precedente caso della cavia, sono in grado di ricreare il tumore e anche se eliminiamo solo alcuni subcloni delle CST, quelle resistenti al farmaco, che quindi sopravvivono, daranno origine ad un nuovo tumore (recidiva) diverso dal tumore di partenza, perché composto dai subcloni rimasti e non da tutti quelli presenti nel tumore iniziale.

Immagini/Pictures
Fonti/Sources
!discovery 40
Questo post è stato condiviso e votato all'interno del discord del team curatori di discovery-it Entra nella nostra community! hive-193212
This post was shared and voted inside the discord by the curators team of discovery-it. Join our community! hive-193212
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @steemstem account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.
This post was shared in the Curation Collective Discord community for curators, and upvoted and reblogged by the @c-squared community account.
If you are a community leader and/or contest organizer, please join the Discord and let us know you if you would like to promote the posting of your community or contest.
@c-squared runs a community witness. Please consider using one of your witness votes on us here