Los ácidos hidrácidos, o hidrácidos como son más conocidos, constituyen una de las clases más importantes de ácidos inorgánicos, cuya característica principal es que se obtienen mediante la combinación de átomos de hidrógeno con un elemento anfígeno (grupo 16 de la tabla periódica, excluyendo al oxígeno) como el azufre, selenio o telurio, o con un halógeno (grupo 17) como el flúor, cloro, bromo o yodo. Son muy comunes entre estos compuestos el ácido clorhídrico, el ácido sulfhídrico y el ácido fluorhídrico.

Formula genral de los hidrácidos. Fuente: @emiliomoron.
De forma general su fórmula química se expresa según el compuesto unido al hidrógeno, si el hidrácido se forma con un halógeno tiene por formula HX, debido a que el estado de oxidación de estos es -1, mientras que si está formado con un elemento anfígeno se representan con la formula H2X, ya que estos actúan su estado de oxidación -2.
Este tipo de ácido binario es muy utilizado en la industria química, pudiendo emplearse en la industria del plástico para iniciar la polimerización de monómeros reactivos como los éteres de vinilo, en la fabricación de cloruro de vinilo y diferentes tipos de solventes. Pero incluso en la industria de los productos de higiene personal, como en pastas dentales y algunos productos cosméticos, y en los productos de limpieza doméstica. Incluso en nuestro organismo, el jugo gástrico además de enzimas contiene ácido clorhídrico.
Importancia del enlace H-X
Los hidrácidos son compuestos cuyos elementos están unidos mediante enlaces covalentes, por lo cual el tipo de elemento que este unido al hidrógeno tiene una importante influencia en las características químicas de cada hidrácido.
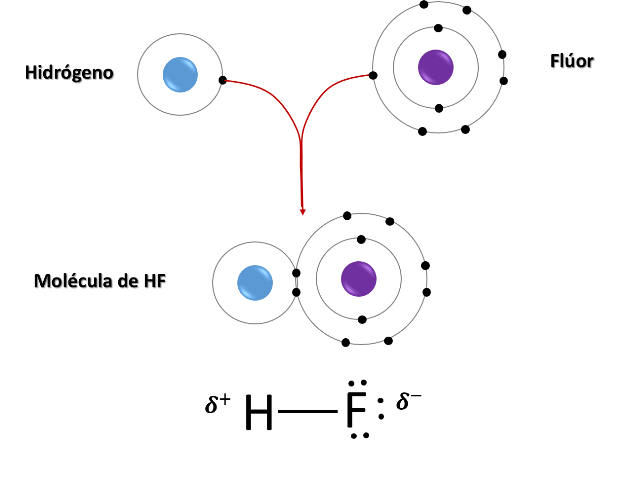
Influencia del enlace HX. Fuente: @emiliomoron.
Como podemos ver en la imagen anterior, tomando como ejemplo el enlace entre el hidrógenos y el flúor para formar el ácido fluorhídrico, después del enlace surge un momento dipolar en la molécula debido a la diferencia de electronegatividades entre el hidrógeno y el flúor, dado que los elementos del grupo 16 y 17 son más electronegativos que el hidrógeno no hay una compartición igualitaria de los electrones, por lo que el electrón del hidrógeno pasa más tiempo en la nube electrónica del flúor, haciendo que este termine con mayor densidad electrónica y por tanto con una carga parcial negativa, δ-.
Por lo tanto, el hidrógeno que ha cedido su único electrón para formar el enlace, termina con una carga parcialmente positiva, lo que induce el momento dipolar en la molécula. Y la magnitud de este momento dipolar dependerá de que tan electronegativo sea el elemento X enlazado al hidrógeno, haciendo que el ácido sea más o menos polar, lo que influye en sus propiedades.
Por ejemplo, cómo podemos observar en la imagen anterior, esta polaridad en la molécula hará que interactúe con otra por los extremos, interactuando con mayor fuerza mientras mayor polaridad tenga la molécula, lo que tendrá como resultado que los hidrácidos más polares tengan los puntos de ebullición o de fusión más altos.
Nomenclatura
Para nombrar los hidrácidos hay que tener en cuenta que su nombre dependerá de la forma en la que se encuentre el compuesto, teniéndose específicamente estos dos casos:
Anhidro
Cuando los hidrácidos se encuentran en su forma gaseosa anhidra, HX(g) se nombran como los hidruros, añadiendo la terminación uro al final del nombre del no metal, por ejemplo el HCl(g) se nombra como cloruro de hidrógeno. Cuando el compuesto corresponde al enlace hidrógeno y un halógeno son los denominados haluros de hidrógeno.
En disolución
Cuando se tiene un compuesto como el HCl disuelto en disolución acuosa, HCl(ac), entonces se nombra colocando primero la palabra ácido y sustituyendo la terminación uro del no metal en la forma anhidra por el sufijo –hidríco, siendo entonces el HCl(ac) el ácido clorhídrico.
Propiedades
A 20°C todos los haluros de hidrógeno se encuentran en forma gaseosa, pero son extremamente solubles en agua, en la cual se ionizan para dar soluciones ácidas, por lo general transparentes o de un ligero tono amarillo según la concentración. Todas las soluciones de los haluros de hidrógeno, excepto el HF, son ácidos fuertes, lo que implica una disociación completa para formar sus iones, protones ácidos y el ion X-, aumentando su acidez conforme lo hace el tamaño del halógeno.
Los hidrácidos también son muy volátiles, y sus soluciones desprenden vapores densos de olores fuertes, que son corrosivos y muy irritantes, esto porque interactúan fuertemente con las moléculas de agua dispersas en el aire, por lo que también se dice que son fumantes.

Los ácidos que desprenden vapores se denominan fumantes. Fuente: Wikipedia.prg.
Como mencionamos antes, en su forma anhidra se encuentran en forma gaseosa, pero los puntos de ebullición de sus formas disueltas son considerablemente altos en comparación con la forma anhidra. Por ejemplo, el punto de ebullición del HCl(ac) es de 48 °C, mientras que el HCl anhidro ebulle a -85 °C.
Por otro lado, los haluros de hidrógeno reaccionan en la forma típica que lo hacen los ácidos, incluyendo la liberación de hidrógeno gaseoso en presencia de metales electropositivos como el Zn o Mg.
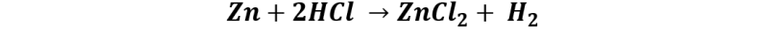
Así como su neutralización con bases y la liberación de dióxido de carbono al reaccionar con carbonatos.
Obtención de los hidrácidos
Los hidrácidos pueden prepararse mediante la disolución directa de la correspondiente forma anhidra en agua.

Sin embargo existen métodos de síntesis que se prefieren sobre estos, los cuales implican disolver sales o minerales en ácidos fuertes a baja temperatura.
Por ejemplo, para la fabricación de cloruro de hidrógeno se agrega ácido sulfúrico concentrado al cloruro de sodio en condiciones frías, de esta forma el ácido sulfúrico dona un protón a un ion del cloruro, formando cloruro de hidrógeno.
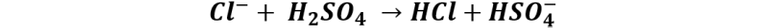
Limpiadores y catalizadores
Los hidrácidos forman soluciones muy ácidas, liberando protones H3O+ que reaccionan fácilmente con otras sustancias.

La reacción anterior se ve favorecida hacia la derecha, lo que determina que sean ácidos muy fuertes, y esencialmente pueden emplearse para disolver diferentes tipos de sustancias. Es por ello que, utilizados en bajas concentraciones, se utilizan como limpiadores de diferentes tipos de superficies. Por ejemplo, el ácido clorhídrico se emplea comúnmente para eliminar manchas en cerámicas y baldosas, los protones ácidos disuelven los compuestos que causan las manchas y las incrustaciones, haciéndolos solubles y permitiendo que sean fácilmente removidos con agua.

Los limpiadores para baños contienenconcentraciones moderadas de HCl. Fuente: @emiliomoron.
Precisamente por su fuerte acides tienen un uso generalizado en la industria química, donde se requieren de catalizadores muy ácidos para acelerar diversas reacciones de síntesis. Por ejemplo, para la síntesis del ácido acético se emplea el ácido yodhídrico, mientras que en la industria de la refinación de petróleo se emplea el ácido fluorhídrico concentrado como catalizador en las reacciones de alquilación.
Bueno amigos, espero les haya gustado la información sobre este muy común tipo de ácidos, ¡hasta la próxima!
Referencias
Chang Raymond (2002). Química. 7a edición McGraw-Hill, México.
ChemLibreText. The Acidity of the Hydrogen Halides
Marianna A. Busch (2018). Halogen Chemistry. Chemistry, Molecular Sciences and Chemical Engineering
Wikipedia.com. Ácido hidrácido
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
Muchas gracias por el apoyo!
Great Post!
!1UP
You have received a 1UP from @luizeba!
@stem-curatorAnd they will bring !PIZZA 🍕
Learn more about our delegation service to earn daily rewards. Join the family on Discord.
Many thanks friends!