Autor: @madridbg, a través de Power Point 2010, utilizando imágenes de dominio público. Rajesh Balouria
Saludos y bienvenidos estimados lectores que hacen vida a diario en la plataforma #Hive y que les apasionan el mundo de la ciencia desde una óptica flexible, mediante la siguiente entrega, estaremos abordando algunos fundamentos conceptuales detrás de los procesos químicos asociados con la transformación de la materia.
Por consiguiente, estaremos compartiendo este tipo de material a través de las comunidades de mayor relevancia científica en la plataforma, haciendo mención a @stemsocial, @stem-espanol y @cervantes.
INTRODUCCIÓN

Para nadie es un secreto de lo fascinante que pueden ser los proceso químicos, aspectos que podemos observar desde la aparición del fuego y como las sustancias se trasforman en materiales totalmente diferentes a los materiales de partida.
Un ejemplo de lo anterior es poder comprender como un trozo de madera arde, genera calor, luz y se obtienen cenizas como residuo diferente a la madera que se tenía al inicio, este proceso es similar, al calentamiento de las rocas rojizas, el cual al ser calentada en presencia de carbón, eran un proceso útil para la obtención de hierro, metal indispensable para la fabricación de armas en tiempo antiguos.

Fig. 2. Proceso de fundición de metal. Autor: Ab5602
Cambios como los anteriores, permitieron a la humanidad aplicar los procesos de observación para lograr determinar la transformación de la materia y obtener conclusiones fehacientes de que la misma está constituida por pequeñas partículas de composición invariables a quienes denominan elementos.
Además de lo anterior, si analizamos la historia nos damos cuenta que para los años 460 a.C , se pensaba que la materia era infinita, aspecto que solo se logra dilucidar con la llegada de la química experimental, fenómeno que ocurrió 2000 años después de la época de Platón, Aristóteles y el propio Demócrito, donde se logra determinar que la materia está formada por átomos que proviene del griego Atomon cuyo significado es indivisible y que la unión de estas da lugar a la formación de los elementos, que cuando se combinan forman moléculas y estas a su vez generan la constitución de la materia en general.
Partiendo de lo anterior mediante estas líneas de escritura, haremos un abordaje conceptual que permita comprenden la ley de las proporciones definidas y su incidencia en la transformación de la materia.
LA CONSERVACIÓN DE LA MATERIA Y LA LEY DE LAS PROPORCIONES DEFINIDAS

Antes de responder a este planteamiento, se hace necesario realizar un abordaje de la historia y recordar que el estudio de la química como disciplina científica inicia con los trabajos de Robert Boyle quien fue el primero en realizar trabajos experimentales aplicando los procesos rigurosos de la ciencia y centrado sus trabajos en el comportamiento y naturaleza de los gases.
Lo cual le permitió realizar aportaciones sobre la constitución atómica de la materia y en función de sus trabajos experimental tuvo la capacidad de enunciar a los elementos como partículas que no pueden descomponerse mediante procedimientos químicos, después de esto los avances de la química fueron lentos y no fue hasta los trabajo de Joseph Priestley (1733-1804) y Antoine Lavoisier donde la química dio apertura a los grandes avances de la humanidad.
Fig. 3. Representación del trabajo experimental. Autor: chiara tiberti
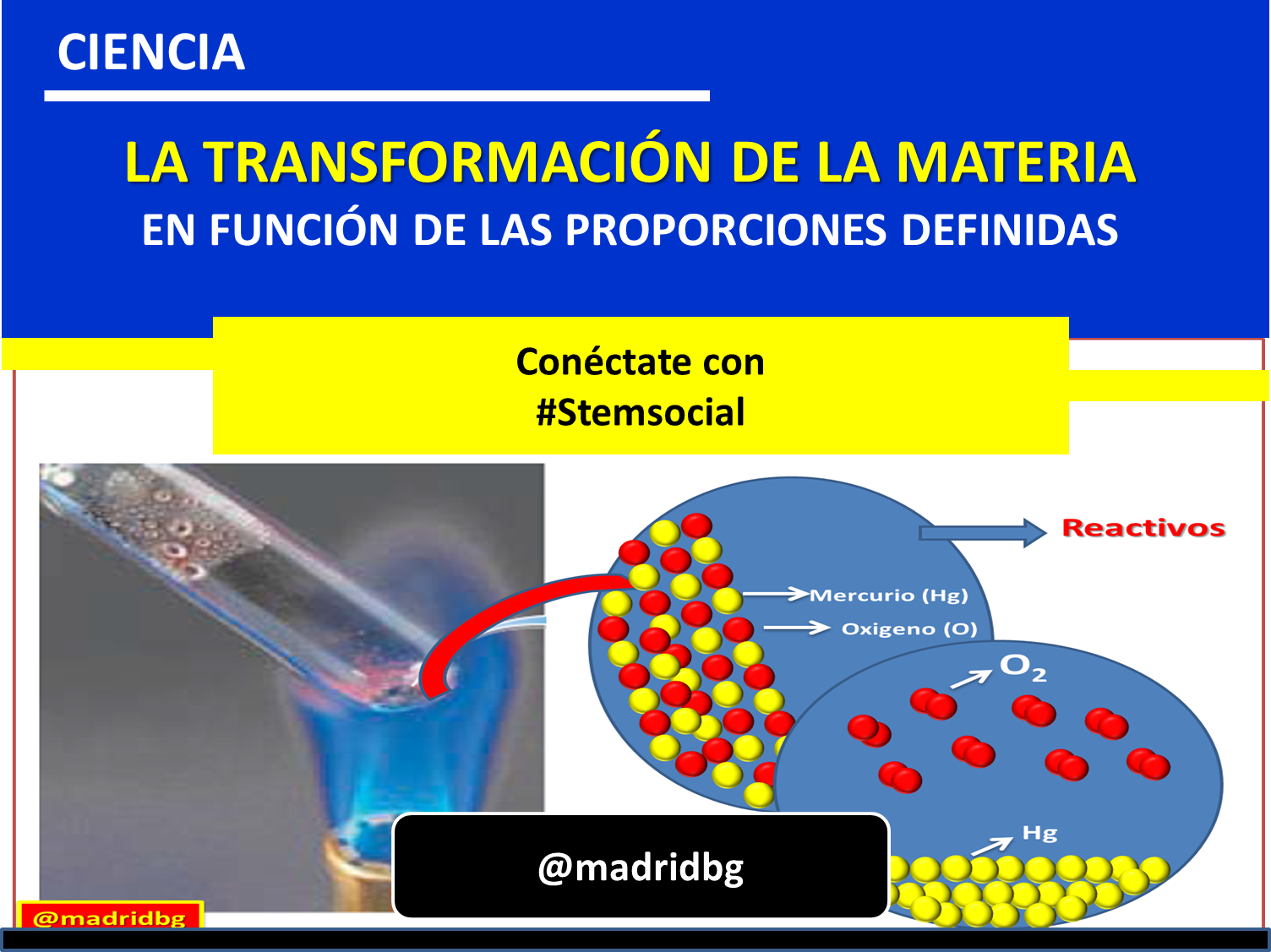
En función de los trabajos de Priestley, se pudo aislar el oxígeno producido por la descomposición de óxido de mercurio, el mismo sigue la ecuación que se presenta en la imagen siguiente, donde poco tiempo después Lavoisier logra demostrar que le oxigeno es la sustancia fundamental en los proceso de combustión, y mediante esta inferencia pudo establecer que la cantidad de reactivo utilizados en un reacción química bajo condiciones aisladas, eran exactamente iguales a la cantidad de productos obtenido. Por lo cual se enuncia la ley de la conservación de la masa, donde se expresa que la masa no se crea ni se destruye, se transforma.
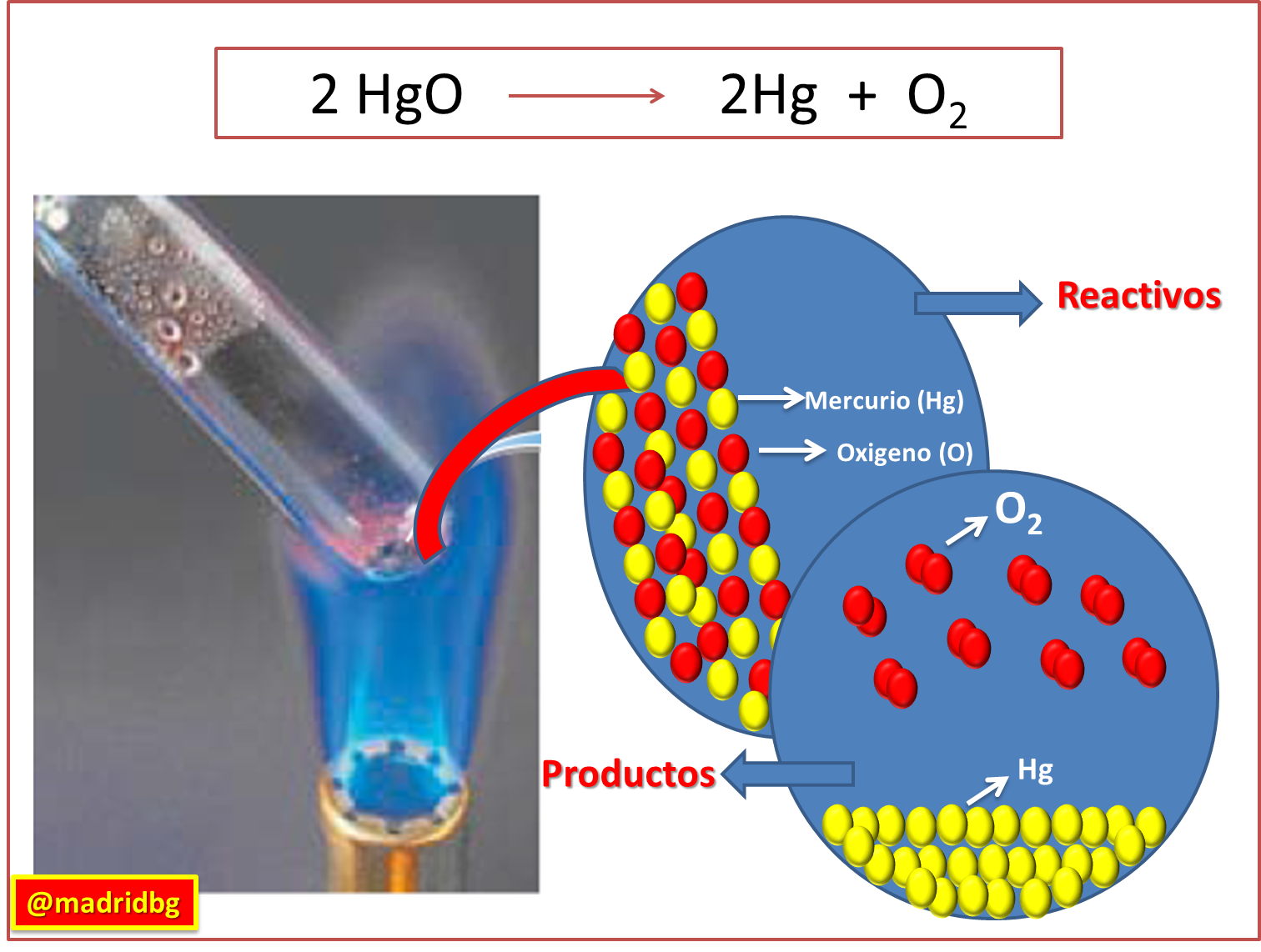
Fig. 4. Reacción de descomposición del óxido de mercurio Autor: @madridbg, a través de Power Point 2010.
Para demostrar el principio de la conservación de la masa, analicemos el siguiente ejercicio propuesto:
Supongamos que tenemos un recipiente cerrado, al cual hemos agregado 3.25g de nitrato de mercurio (III) (Hg (NO 3) 2 ) en disolución acuosa y 3.32g de yoduro de potasio (KI) también en disolución, podemos observar que con el transcurrir del tiempo vamos a obtener 4.55g yoduro de mercurio (II), material insoluble de color naranja (HgI 2) y 2.02g de nitrato de potasio (KNO3), estando consiente que el agua obtenida fue evaporada.
En función de lo anterior, analicemos la estequiometria implementada en la imagen siguiente y comparemos las masas de los reactivos y producto obtenidos.
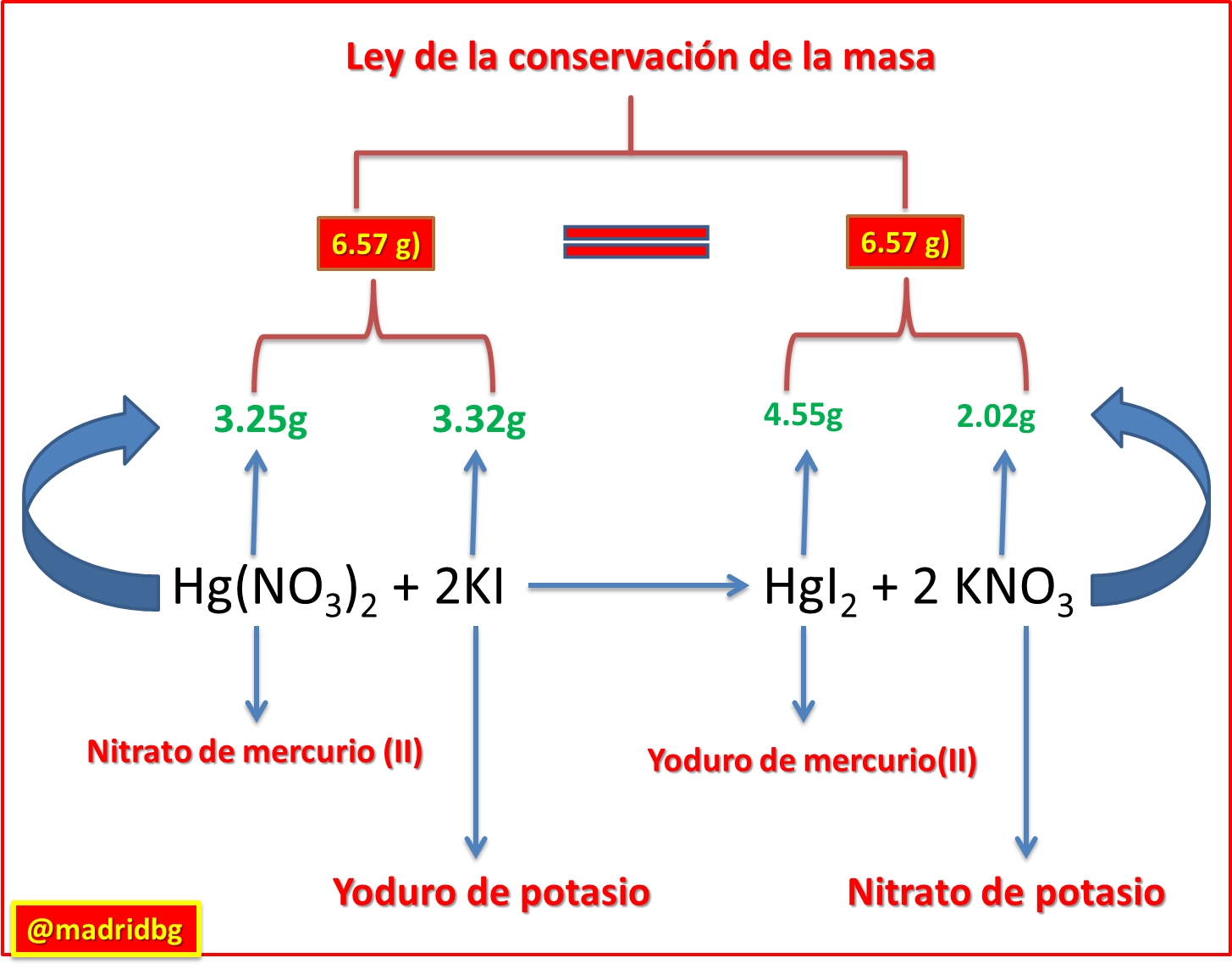
Fig. 5. Estequiometria de las reacciones químicas en función de la ley de conservación de masa. Autor: @madridbg, a través de Power Point 2010.
Como podemos observar en la imagen anterior, los reactivos y los productos son sustancias totalmente diferentes con propiedades físicas y químicas diferentes aunque mantienen la relación entre la masa, ya que de cierta forma la sumatoria de la masa invertida en los reactivos se transformó y ahora forma parte de los productos, bajos estos principios se define la ley de la conservación de la masa.
En este sentido, los eventos químicos desencadenaron nuevos procesos experimentales ya que poco tiempo después Joseph Proust (1754-1826), establece la ley de las proporciones definidas, donde se manifiesta que cuando la sustancia es pura tendrá las mismas proporciones en masa sin importar las cantidades de sustancia, de tal manera que toda muestra de dióxido de carbono contiene, 3 partes de carbono y 8 partes de oxígeno, a su vez toda muestra de agua estará constituida por 1 parte de hidrógeno y 8 partes de oxígeno. De tal manera que podemos establecer que los elementos se combinan en proporciones específicas y no al azar.
CONSIDERACIONES FINALES

Como pudimos observar a lo largo de estas líneas de escritura, los fundamentos de la química parten de sistemas observacionales que pueden ser mejorados mediante los procesos o trabajos experimentales que realizan los científicos y que cualquiera de estos procesos puede ser de fácil comprensión si se sigue una metodología de aprendizaje adecuada.
En este punto, la finalidad de estos escritos mediante una óptica flexible es alfabetizar a la población en general sobre la importancia de la química en la evolución de la humanidad.
BIBLIOGRAFÍA CONSULTADA

[1] McMURRY E., John y Fay C., Robert. (2008). Química general. Quinta edición PEARSON EDUCACIÓN, México, 2009 ISBN: 978-970-26 1286-5.
[2] Ralph, H. Petrucci, William S. Harwood, E. Geoffrey Herring. (2003). QUIMICA GENERAL. Octava edición. PEARSON EDUCACIÓN. S.A., Madrid.
DE INTERÉS

1. La imagen de portada fue realizada por @madridbg, utilizado imagen de dominio publico
2. Para más información relacionada con las áreas de ciencia, tecnología, ingeniería y matemáticas, no dudes en visitar #stemsocial y #stem-espanol, son comunidades que promueven avances científicos en estas áreas

#posh twitter:
The rewards earned on this comment will go directly to the person sharing the post on Twitter as long as they are registered with @poshtoken. Sign up at https://hiveposh.com.
Su post ha sido valorado por @ramonycajal
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
Your content has been voted as a part of Encouragement program. Keep up the good work!
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for new Proposal
Delegate HP and earn more