¡Hola amigos!
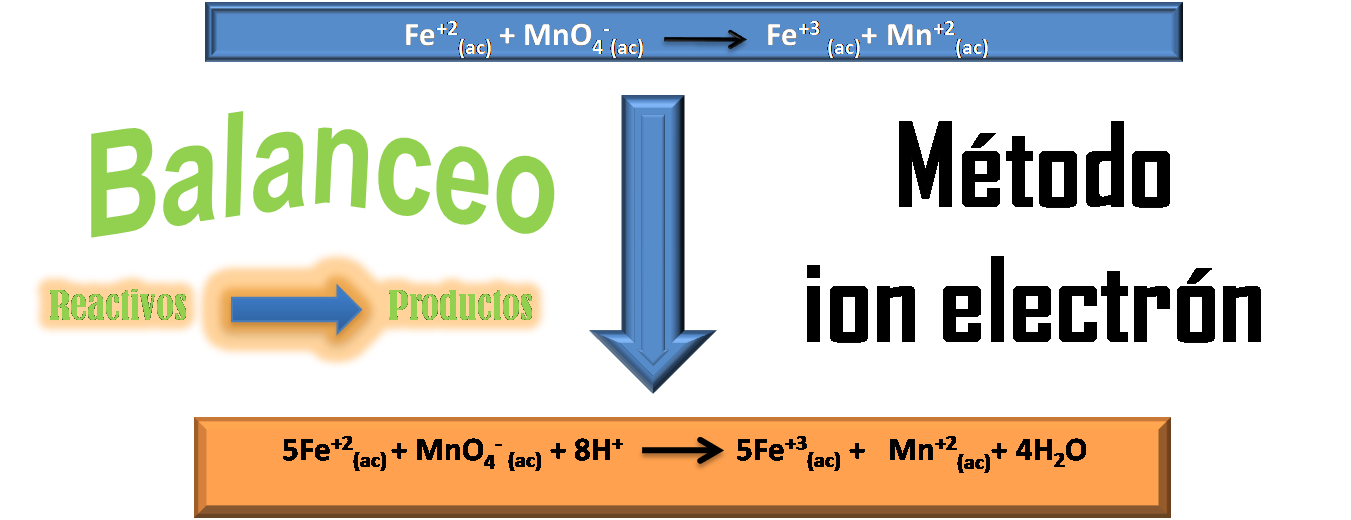
El balanceo básicamente consiste en garantizar que en el lado de los reactivos se encuentre el mismo número de átomos que en el lado de los productos. En algunos casos esta igualdad se puede lograr realizando un simple tanteo y empleando coeficientes estequiométricos adecuados que logren el ajuste.
Ahora bien, cuando se trabaja con reacciones de óxido-reducción, no solo debe garantizarse un ajuste de átomos en la ecuación sino también un ajuste de cargas eléctricas, por lo que no resulta tan sencillo. Es por ello que en este post les quiero mostrar el método conocido como “Método Ion electrón” que consta de una serie de pasos y con el que se pueden balancear este tipo de reacciones. ¡Les invito a leer!
Fuente: @yusvelasquez
En estas reacciones el número total de electrones perdidos por el agente reductor debe ser igual al número total de electrones ganados por el agente oxidante, ya que los electrones no se pueden crear ni perder, por lo que se puede emplear este método como guía para balancearlas.
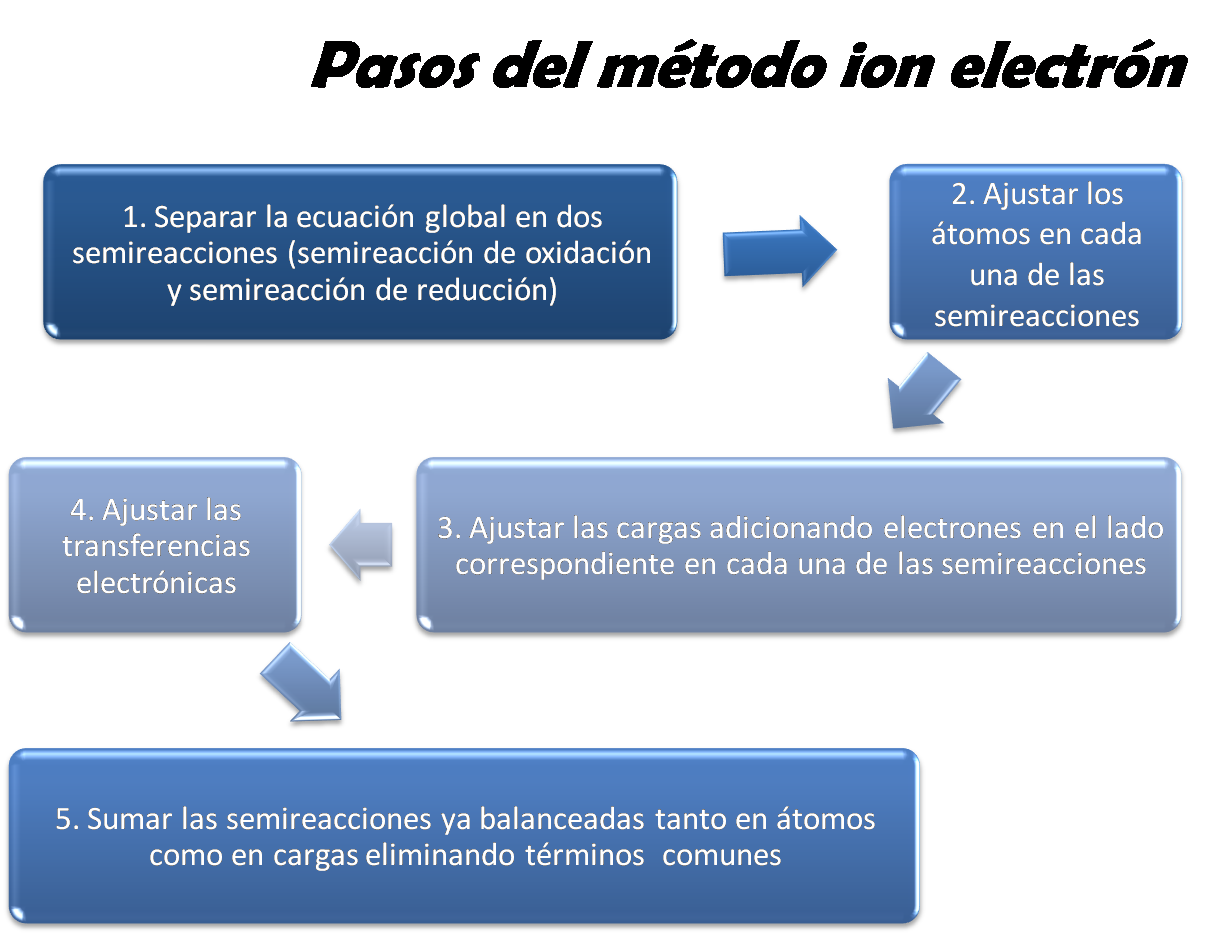
Descripción del método
Este método en forma general se basa en separar la ecuación global no ajustada en dos semireacciones (semireacción de oxidación y semireacción de reducción), posteriormente cada una se balancea por separado tanto en átomos como en carga, se igualan las transferencias electrónicas, se suman, se eliminan términos semejantes y se obtiene la ecuaciónn balanceada. Dichos pasos se muestran en la siguiente figura:
Fuente: @yusvelasquez
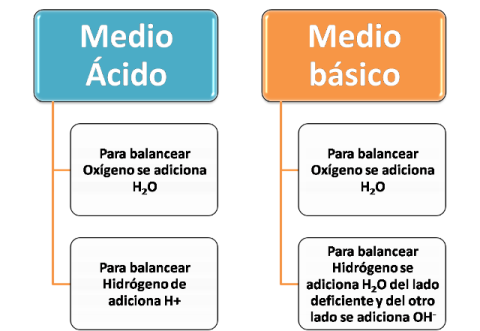
Hay que tomar en cuenta el medio donde se lleva a cabo la reacción, de esta manera se puede adicionar H3O+, OH- y H2O para lograr el ajuste, existen varias formas de lograrlo, a continuación se muestra una de ellas para igualar el oxígeno e hidrógeno:
Fuente: @yusvelasquez
Aplicación del método
Para aplicar los pasos mostrados anteriormente empezaremos con el balanceo de una ecuación iónica en un medio ácido.
Ecuación iónica no ajustada

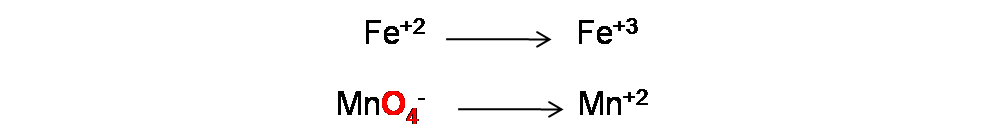
Paso 1: Comenzaremos por separar la ecuación global en dos semireacciones

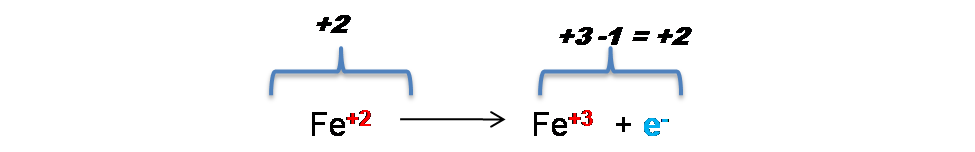
En este caso el Fe pasa de un número de oxidación +2 a +3 aumentando algebraicamente, por lo que se oxida y el Mn pasa de un número de oxidación +7 a +2 disminuyendo algebraicamente por lo que se reduce.
Paso 2: Balanceo de átomos: Como se puede observar la 1era semireacción está completamente balanceada en función a los átomos, ya que del lado izquierdo hay 1 átomo de Fe y del lado derecho 1 átomo de Fe.
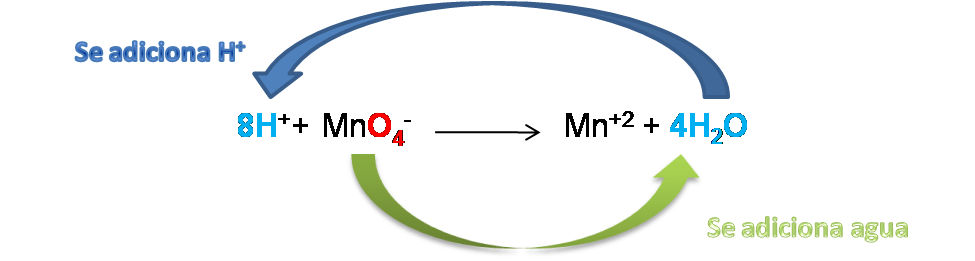
En la 2da semireacción el Mn está balanceado mientras que los átomos de oxígeno no están balanceados, ya que se tienen 4 átomos del lado izquierdo y 0 en el lado derecho.
Como la reacción se lleva en medio ácido, se procede a adicionar 4 moléculas de H2O del lado de los productos, de esta manera al introducir hidrógeno se pueden adicionar 8H+ del lado de los reactivos para lograr el ajuste.
Paso 3: Balance de cargas. En este paso se deben adicionar e- del lado necesario. Para determinar las cargas solo se debe multiplicar el coficiente del ion por la carga que posee.
En la 1era semireacción se puede observar que inicialmente se tinen 2 cargas positivas del lado de los reactivos y 3 cargas positivas del lado de los productos, por lo que si se adiciona 1e- del lado de los reactivos se logra el ajuste de las cargas.
En el caso de la segunda semireacción se tienen 7 cargas positivas del lado de los reactivos y 2 cargas positivas del lado de los productos por lo que si se adicionan 5 e- del lado de los reactivos se logra el ajuste

Por lo que se ya en este paso se tienen ambas semireacciones balanceadas tanto en átomos como en cargas.
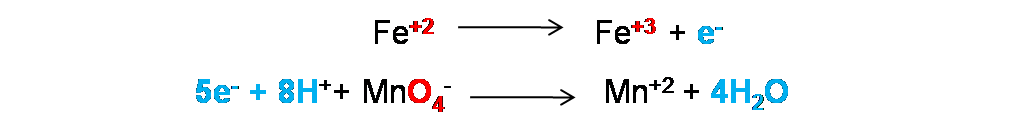
Paso 4: Ajuste de transferencias electrónicas. En este caso se debe garantizar que los electrones perdidos sean igual a los electrones ganados. Como se observa el Fe perdió 1e- y el permanganato gano 5e- por lo que no están ajustadas.
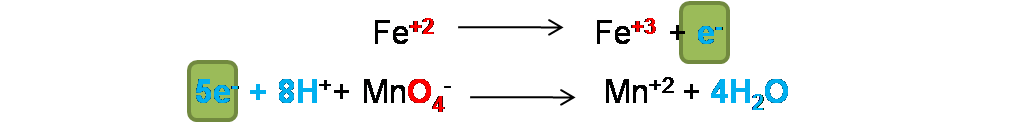
Se pueden ajustar solo intercambiando los coeficientes o en este caso multiplicando la primera semireacción por 5.
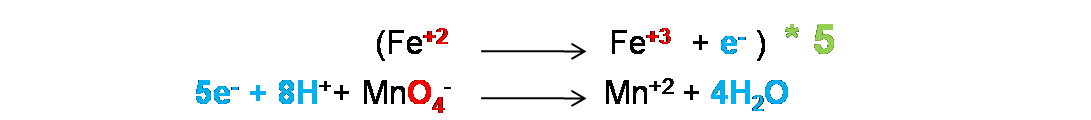
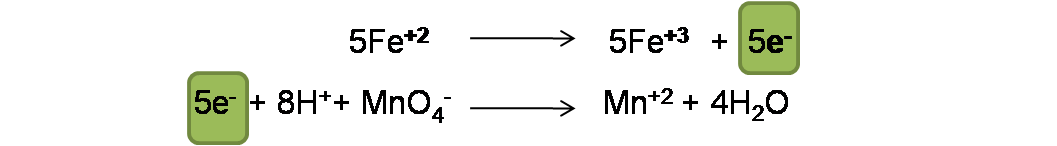
Paso 5: Suma de las semireacciones. En este paso se procede a eliminar términos semejantes en ambas reacciones y agrupar los reactivos y los productos de la siguiente forma:
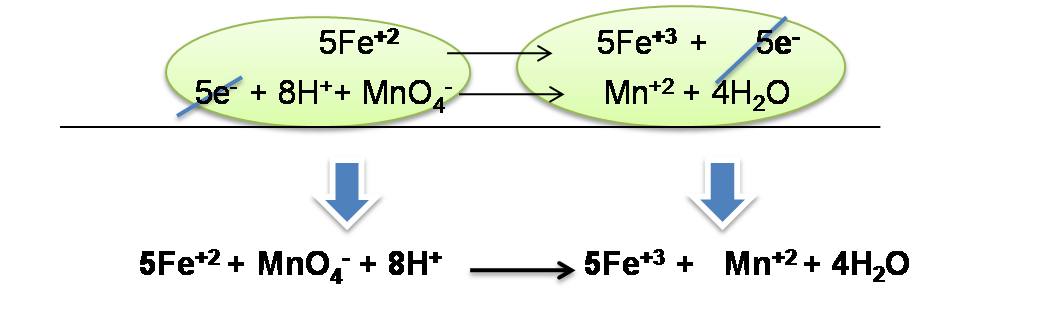
Finalmente se puede verificar que la ecuación está quimicamente balanceada tanto en átomos como en cargas.
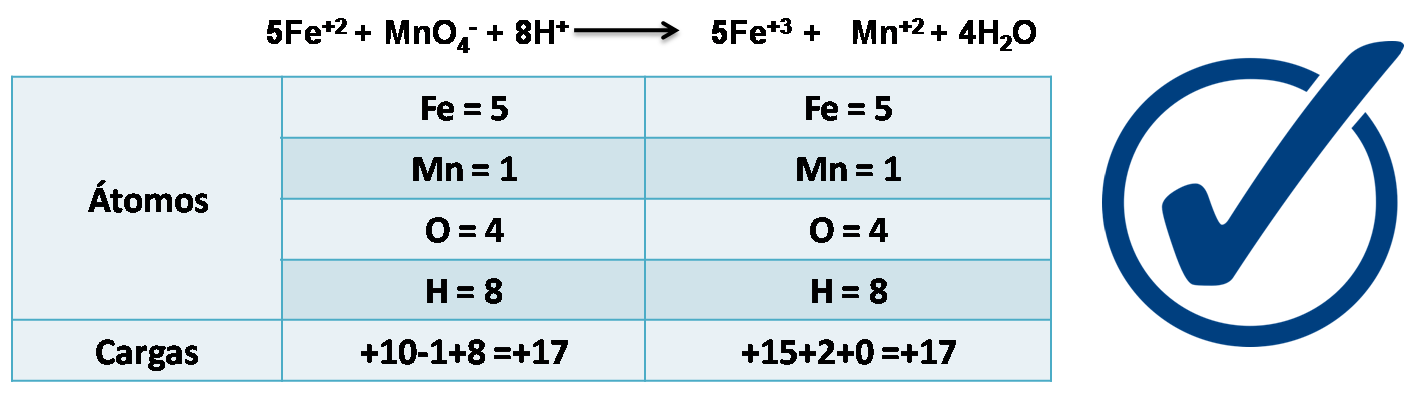
Fuente: Imagen realizada en power point con imagen de dominio público: pixabay.com
Como vemos este tipo de reacciones no se pueden balancear por simple tanteo por lo que este método permite el ajuste de reacciones un poco más complicada y que con la práctica se pueden llegar a dominar los pasos.
¡Hasta una próxima oportunidad, gracias por leer!
Referencias
- Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editoral Interamericana
- Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
Congratulations @yusvelasquez! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s):
Your next target is to reach 800 replies.
You can view your badges on your board and compare yourself to others in the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPCheck out the last post from @hivebuzz:
Support the HiveBuzz project. Vote for our proposal!