¡Hola estimados amigos!
Fuente: @yusvelasquez
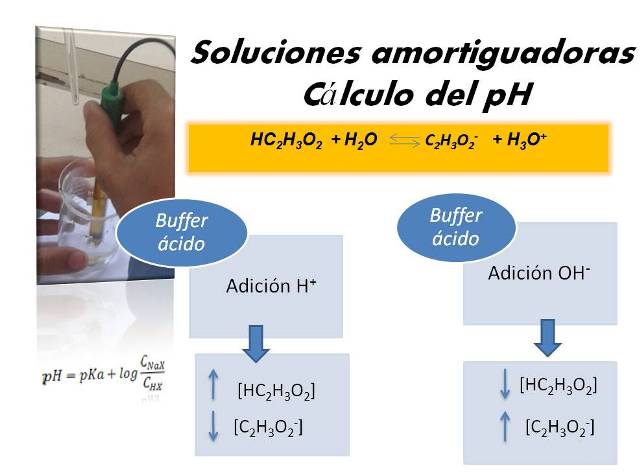
En post anteriores he presentado información sobre la composición de este tipo de soluciones también llamadas buffer, y la importancia que tienen en diversas áreas, en especial la biología. Ejemplos de ellas son el agua de mar y la sangre.
Ahora bien, en el estudio del equilibrio que se establece con especies iónicas, a las cuales pertenecen las soluciones buffer, resulta importante no solo identificar las especies, sino también dominar como se puede calcular de pH dependiendo de su naturaleza, es así como debemos diferenciar si corresponde a un ácido débil, una base fuerte, una solución salina, entre otros. Es aquí donde se presenta confusión en las ecuaciones que deben emplearse. Es por ello que en este post, quiero mostrar cómo se puede calcular el pH de las soluciones amortiguadoras.
Comencemos por recordar que existen dos tipos de soluciones amortiguadoras o buffer, buffer ácido y buffer básico. Enfoquemos el estudio en un buffer ácido. Un buffer ácido está formado por un ácido débil (HX) y su sal (NaX). Para este tipo se tiene entonces las siguientes reacciones, escritas en forma general:
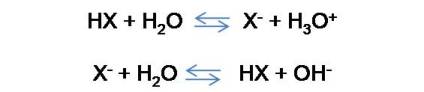
Si analizamos las reacciones, podemos observar que en la primera reacción de equilibrio, la [HX] se reduce en la misma cantidad que [H3O+] aumenta, mientras que en la segunda reacción de equilibrio, se observa que la [HX] aumenta en la misma cantidad que [OH-].
Si se realiza un balance de masa, y la concentración del ácido se relaciona con su concentración analítica (CHX) , tendremos entonces la siguiente expresión:
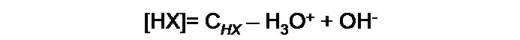
Si analizamos X-, observaremos que en la primera reacción de equilibrio [X-] aumenta en la misma cantidad que [H3O+], y en el segundo equilibrio disminuye en la misma cantidad que [OH-]. La expresión del balance de masa en este caso es:
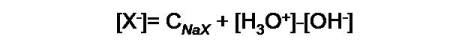
Ambas expresiones se pueden simplificar ya que generalmente la diferencia entre estas concentraciones de estas dos especies es muy pequeña si se compara con la concentración del ácido y la base conjugada.
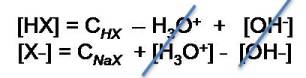
Para obtener:
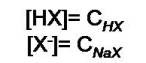
Al sustituir las expresiones [HX] y [X-] en la expresión de la constante de disociación del ácido (Ka) se obtiene:
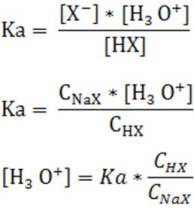
Hay que tomar en cuenta que las suposiciones realizadas a veces no funcionan cuando se trabaja con ácidos o bases cuyas constantes de disociación son mayores a 10-3, o cuando la concentración molar del compuesto es muy pequeña, por lo que en estos casos se debe tomar en consideración [H3O+] y [OH-], y se deben validar las suposiciones al final.
En la bibliografía podemos encontrar la ecuación de Henderson-Hasselbalch, la cual se obtiene de la siguiente manera, expresando cada término como su logaritmo negativo.
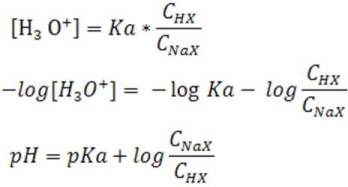
Aplicación de la ecuación de Henderson-Hasselbalch en el cálculo del pH de una solución buffer.

Calculemos el cambio que se produce en el pH de una solución reguladora que es 0.10M de HC2H3O2 y 0.10 M en NaC2H3O2 al adicionar 0.010 moles de HCl a 1 L.
Comenzaremos por calcular el pH de la solución buffer antes de adicionar el HCl para así determinar cuánto es la variación.
Empleando la ecuación de Henderson se tiene:
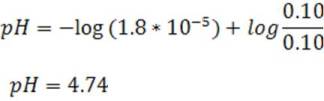
Calculemos ahora el pH al adicionar 0.010 moles de HCl a 1 L de solución buffer
En este caso la [HCl] = 0.010M
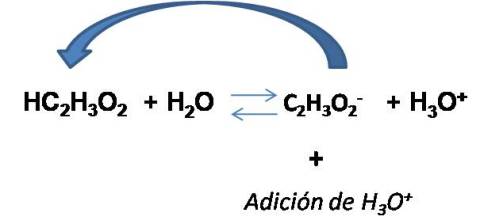
Si analizamos la reacción, podemos observar que al adicionar cierta cantidad de ácido, éste reaccionará con la base conjugada de las solución buffer reduciendo su concentración y aumentando la [HC2H3O2]. Por tanto, las nuevas concentraciones son:
[HC2H3O2] ≈ (0.10+ 0.010) M = 0.11 M
[C2H3O2-] ≈ (0.10 – 0.010) M = 0.09 M
Al sustituir en la ecuación de Henderson se tiene,
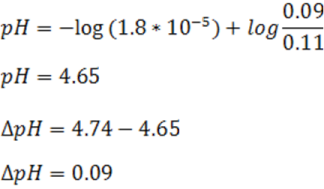
Como se puede observar el cambio de pH es muy pequeño, en este caso de 0.09 unidades resistiendo así la adición del ácido.

Por otro lado, en la solución también puede producirse un cambio al adicionar base.
Calculemos ahora el pH al adicionar 0.010 moles de NaOH a 1 L de solución buffer.
En este caso la [NaOH] = 0.010M
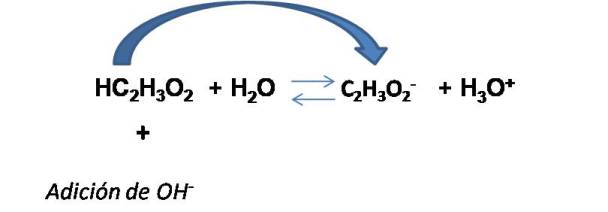
Si analizamos la reacción, podemos observar que al adicionar cierta cantidad de base (OH- la concentración del ácido disminuye y aumenta la [C2H3O2-]. Por tanto, las nuevas concentraciones son:
[HC2H3O2] ≈ (0.10 - 0.010) M = 0.09 M
[C2H3O2-] ≈ (0.10 + 0.010) M = 0.11M
Al sustituir en la ecuación de Henderson se tiene,
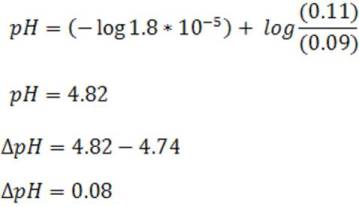
Como se puede observar el cambio de pH es muy pequeño en este caso de 0.08 unidades, resistiendo así la adición de la base.
Con la información presentada anteriormente se pretende resaltar la importancia de reconocer las soluciones amortiguadoras o buffer, para así determinar su pH y analizar cómo pueden verse afectadas cuando suceden alteraciones, y determinar así cuales son los componentes adecuados y sus respectivas composiciones.
¡Hasta una próxima oportunidad, gracias por leer!
Referencias
- Skoog, W. (2000). Química Analítica. Mc Graw Hill
- Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editoral Interamericana
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.
¡Gracias por el apoyo!