Hola estimados amigos!
Fuente: @yusvelasquez
Como recordaremos existen 4 tipos de sales:
- Sales de ácidos fuertes y bases fuertes
- Sales de ácidos fuertes y bases débiles
- Sales de ácidos débiles y bases fuertes
- Sales de ácidos débiles y bases débiles
En este post, abordaremos los dos últimos casos. Comencemos con las sales provenientes de ácido débiles y bases fuertes:
Un ejemplo de estas sales es el acetato de sodio de fórmula NaCH3CO2, el cual es muy utilizado a nivel industrial, como conservante en la industria de los alimentos, como regulador de pH en el campo de la bioquímica, así como tambien en la industria textil para tratar las corrientes residuales ácidas.

Acetato de sodio. Fuente: wikipedia.com
Si analizamos este caso, el ion CH3CO2- proviene de un ácido débil, por tanto tendrá tendencia a hidrolizarse y determina el pH de la solución.
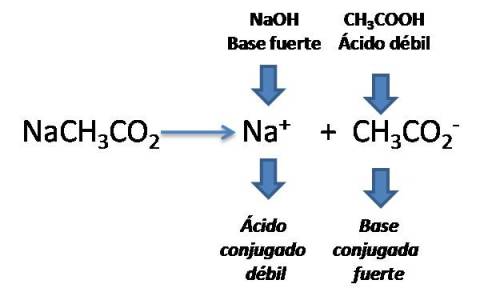
Cálculo del pH
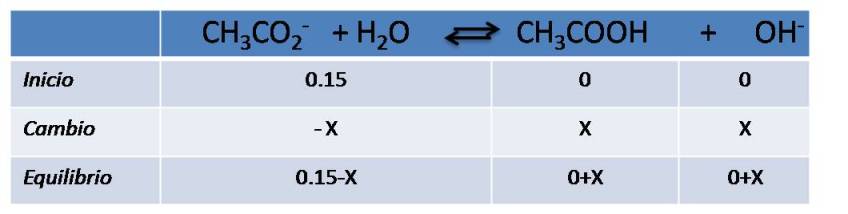
Aquí se puede seguir el mismo procedimiento descrito en los casos anteriores, basado en el cuadro de equilibrio. Calcularemos el pH para una solución de acetato de sodio 0.15 mol/L.
Escribimos la reacción de hidrólisis y completamos la información.
Expresamos la constante de equilibrio (Kb) y calculamos el valor de la constante de la base conjugada partiendo del valor del ácido de donde se formó esta base. En este caso emplearemos 1.8*10-5 que corresponde a la constante del ácido acético según la bibliografía.
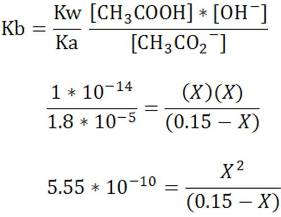
Resolvemos la ecuación y calculamos el pH con la concentración de H3O+
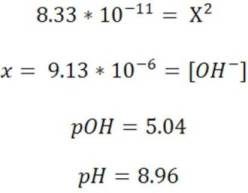
Como vemos el pH es > 7.0
Podemos concluir entonces, que los aniones básicos que provengan de ácidos débiles producen soluciones básicas.
Finalmente en el cuarto caso tenemos las sales que provienen de ácidos débiles y bases débiles.
Si nos basamos en lo analizado en los casos anteriores podemos deducir que tanto el catión como el anión tendrán fuerte tendencia a hidrolizarse ya que ambos provienen de especies débiles, por lo que aquí hay que tomar en cuenta quien prevalece, así se tienen 3 subcasos que estudiaremos a continuación:
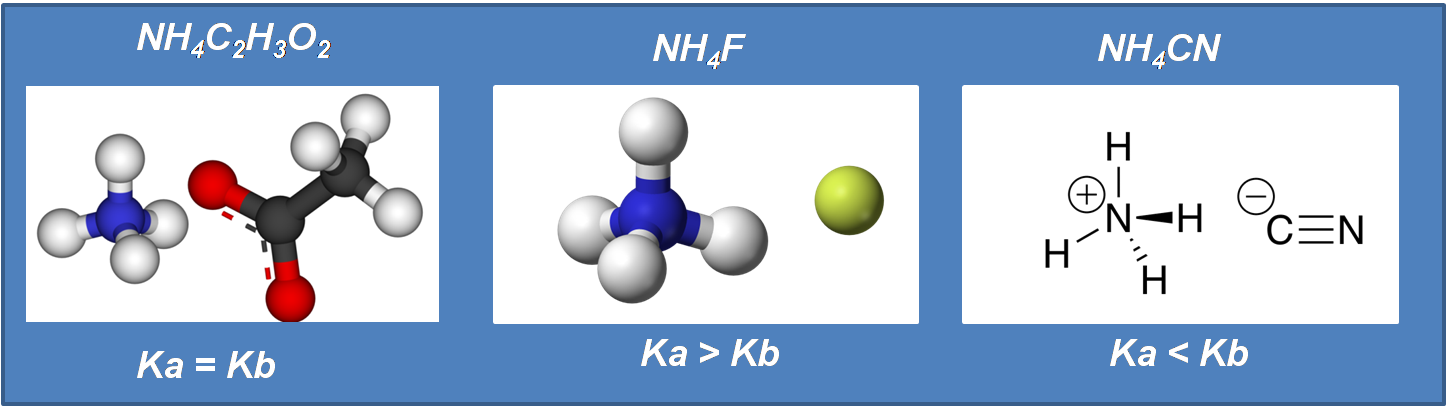
Imagen realizada en power con imágenes de domino público: 1,2.3
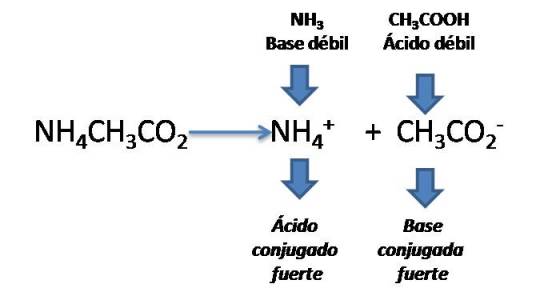
Cuando Ka = Kb
Por ejemplo el acetato de amonio NH4CH3CO2.
Si comparamos las constantes del ácido y la base tendremos que ambas son iguales por lo que en este caso el pH será Neutro.
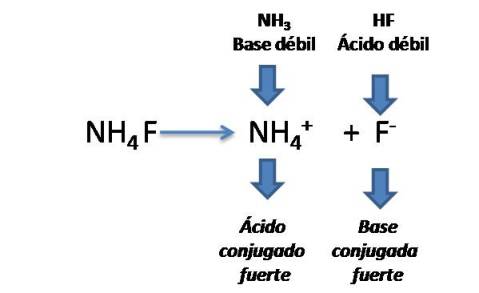
Cuando Ka>Kb
Por ejemplo el fluoruro de amonio NH4F.
Si comparamos las constantes del ácido y la base tendremos que la constante ácida es mayor a la constante básica, por lo que en este caso el pH será ácido.
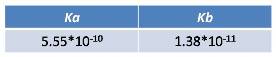
Cuando Ka<Kb
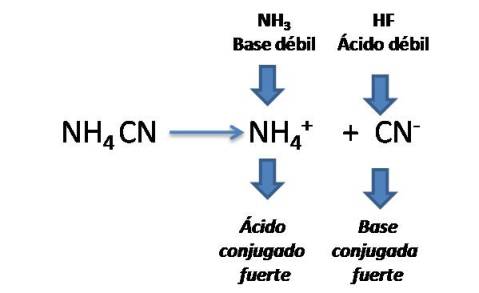
Por ejemplo el cianuro de amonio NH4CN.
Si comparamos las constantes del ácido y la base tendremos que la constante ácida es menor a la constante básica, por lo que en este caso el pH será básico.
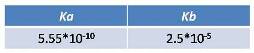
Cálculo del pH
Calcularemos el pH de una solución 0.30M de NH4NO2.
Si analizamos esta sal, podemos ver que tanto el NH4+ y el NO2- tienen tendencia a hidrolizarse, por lo que se llevará a cabo la reacción con cada ion.
Comencemos con la hidrólisis del NH4+
Escribimos la reacción y completamos el cuadro de equilibrio
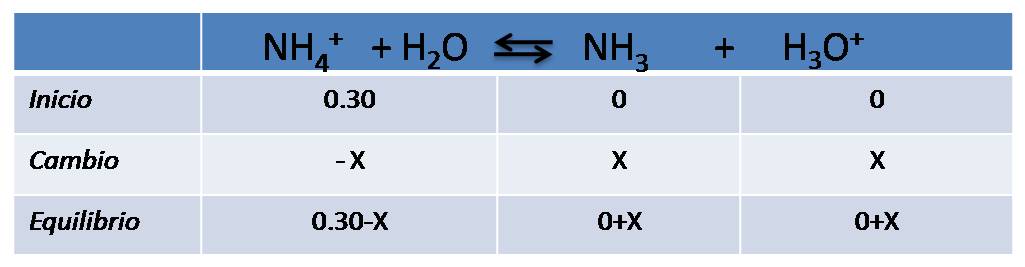
Expresamos la constante de equilibrio (Ka) y calculamos el valor de la constante del ácido conjugado partiendo del valor de la base de donde se formó éste ácido. En este caso emplearemos 1.8*10-5 que corresponde a la constante del amoníaco según la bibliografía.
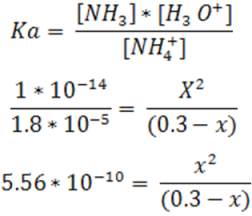
Se resuelve la ecuación y se obtiene el valor de la concentración de H3O+
Ahora, estudiemos la hidrólisis del NO2-
Completamos el cuadro de equilibrio de la misma forma que el caso anterior
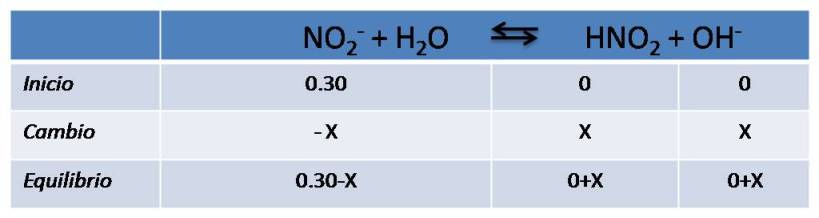
Expresamos la constante de equilibrio (Kb) y calculamos el valor de la constante de la base conjugada partiendo del valor del ácido de donde se formó ésta base. En este caso emplearemos 5.1*10-4 que corresponde a la constante del HNO2 según la bibliografía.
Se resuelve la ecuación y se obtiene el valor de la concentración de OH-
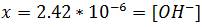
Como cada reacción de hidrólisis aporta a la solución iones H3O+ y OH- la reacción entre ellos será entonces
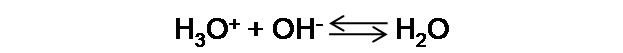
Como se puede observar la concentración de H3O+ es mayor a la concentración de OH-, por lo que debemos calcular el exceso de este ion, lo cual determinará el pH de la solución.
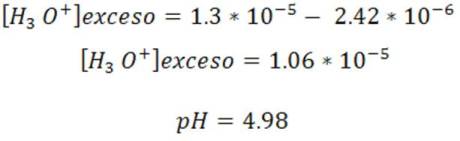
Como vemos el pH es ácido, esto debido a que Ka es mayor que Kb.
Podemos concluir entonces que, todas las sales se pueden analizar de la misma forma y predecir si el pH de la solución será ácido, básico o neutro de forma cualitativa. Por otra parte la reacción de hidrólisis permitirá determinar bien sea la concentración de H3O+ o la concentración del OH- para calcular el pH.
En la siguiente figura se resume todos los casos estudiados:
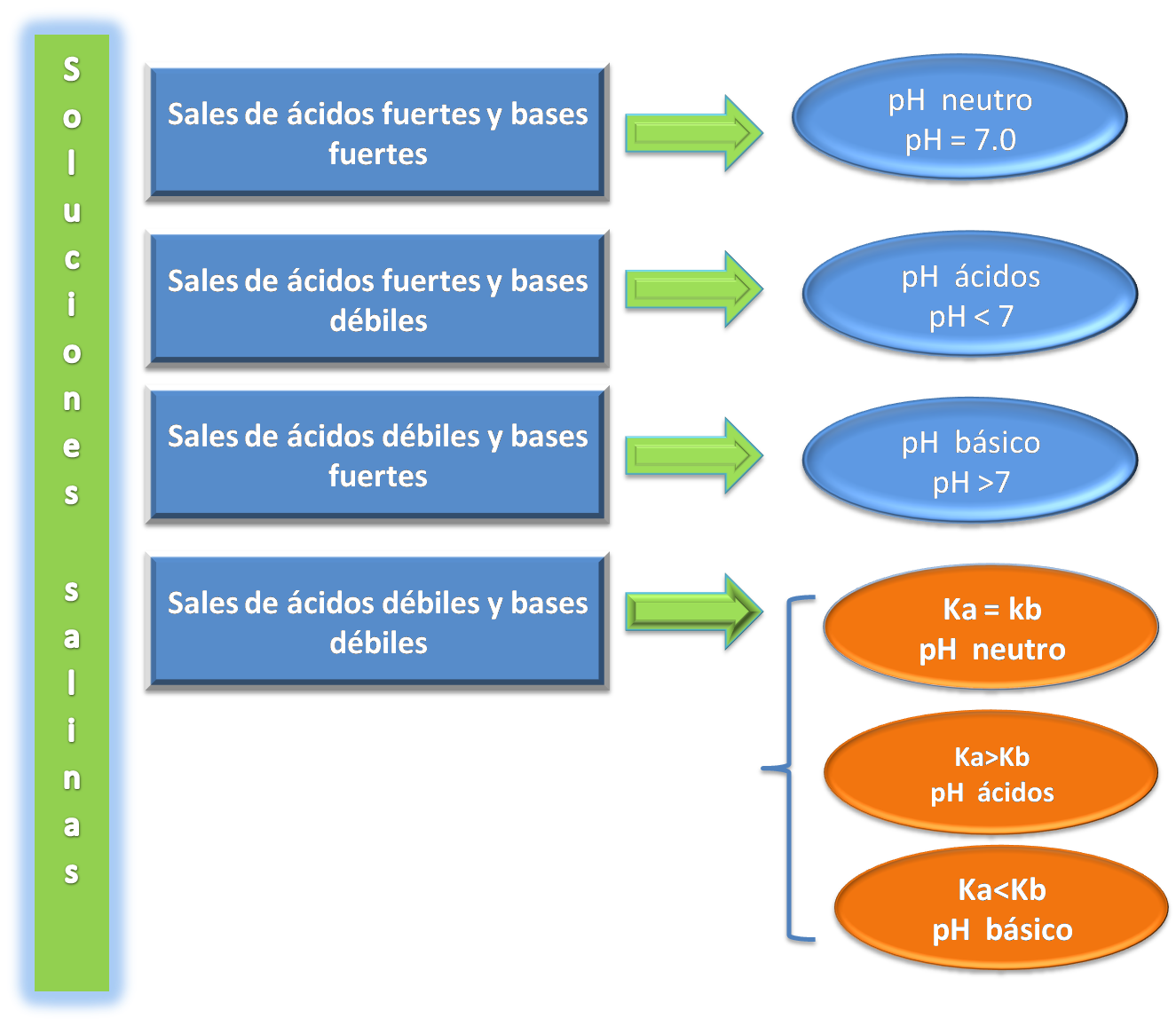
Fuente: @yusvelasquez
¡Hasta aquí el presente post, espero que la información presentada les sea muy útil, gracias por leer, hasta una próxima oportunidad!
Referencias
- Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
- Fontal, B. y Contreras, S. (1988). Equilibrio iónico. Universidad de los Andes.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.
¡Muchas gracias por el apoyo!
Your content has been voted as a part of Encouragement program. Keep up the good work!
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for Proposal
Delegate HP and earn more