Muy buenas a todos, en este post se hablará sobre las cualidades de las moléculas orgánicas, que son clave para su compresión y su posterior utilidad en diversos ejercicios.
Propiedades ondulatorias de los electrones:
La forma de representar los orbitales es a través de las ondas, el orbital 1s es simétricamente esférico y por lo general se representa por un círculo con un núcleo en el centro y una carga positiva o negativa para indicar el signo instantáneo de la longitud de onda.
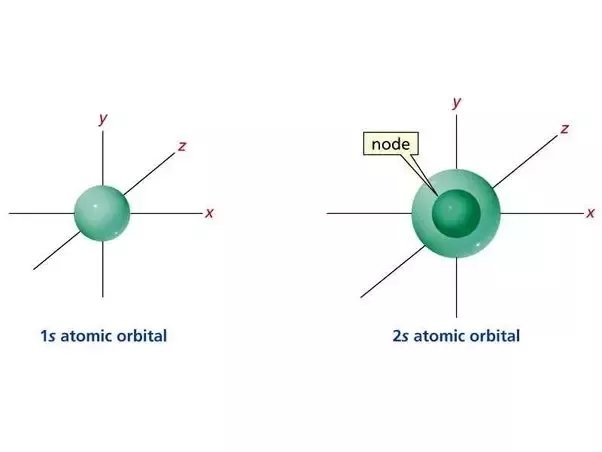
Ejemplo del orbital 1s. Fuente de imagen
El orbital 2p se representa por 2 lóbulos separados por un nodo que están desfasados entre sí, si uno es positivo el otro es negativo.
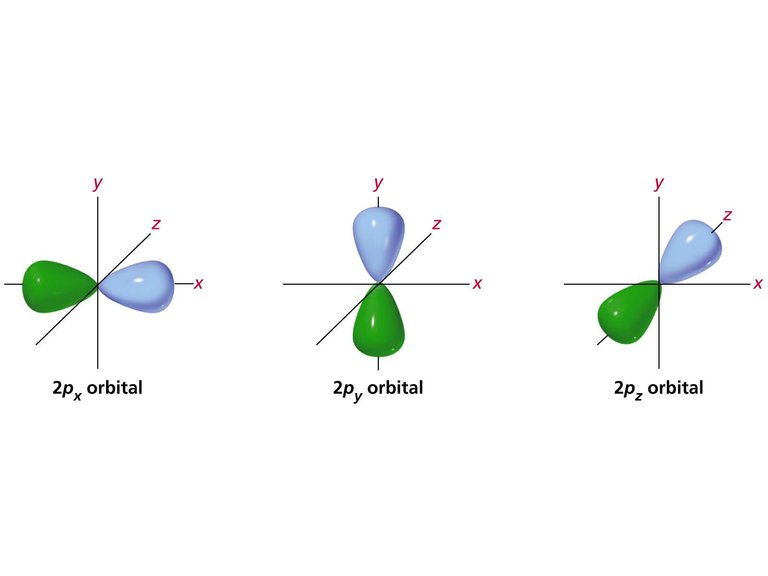
Ejemplo de los orbitales 2p. Fuente de imagen
Los orbitales atómicos pueden combinarse y traslaparse para generar ondas estacionarias más complejas. Podemos sumar y restar sus funciones de onda para obtener las funciones de onda de nuevos orbitales. Este proceso se conoce como combinación lineal de orbitales atómicos (CLOA). El número de nuevos orbitales generados siempre es igual al número de orbitales con el que iniciamos. Para esto existen dos casos:
1-Cuando interactúan los orbitales de átomos diferentes éstos producen orbitales moleculares (OM) que derivan en interacciones de enlace (o de antienlace).
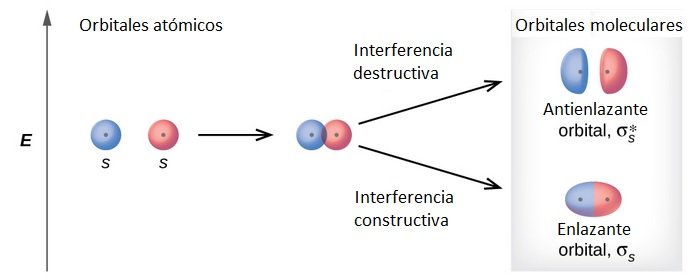
Representación de los orbitales moleculares. Fuente de imagen
2-Cuando interactúan los orbitales del mismo átomo, producen orbitales atómicos híbridos que definen la geometría de los enlaces.
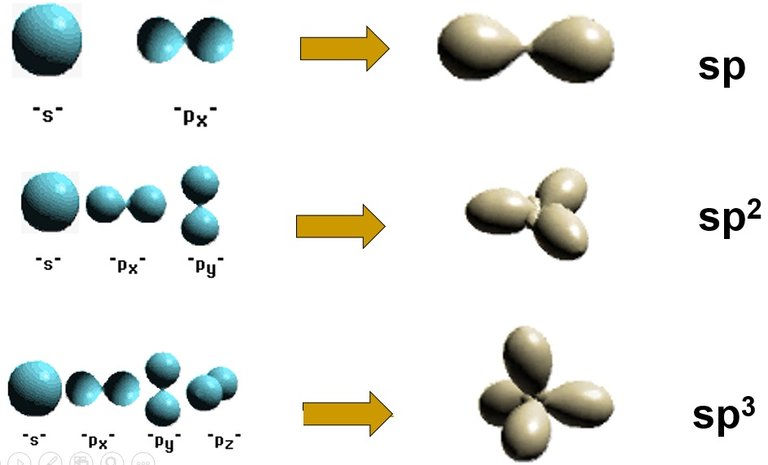
Ejemplo de orbitales híbridos. Fuente de imagen
Orbitales moleculares:
La longitud de enlace es la distancia óptima que hay entre los núcleos que equilibran la atracción y la repulsión. Por ejemplo, la unión de dos orbitales 1s del hidrogeno forman un orbital molecular de enlace sigma, que es el enlace más común de las sustancias orgánicas.
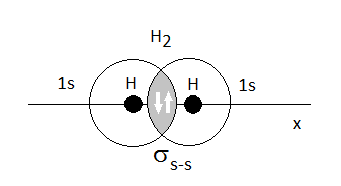
Enlace sigma entre hidrógenos. Fuente de imagen
Cuando dos orbitales moleculares se traslapan fuera de fase forman un orbital molecular de antienlace, porque las dos funciones de ondas al tener signos opuestos se cancelan dando como resultado un nodo que separa a los dos átomos.
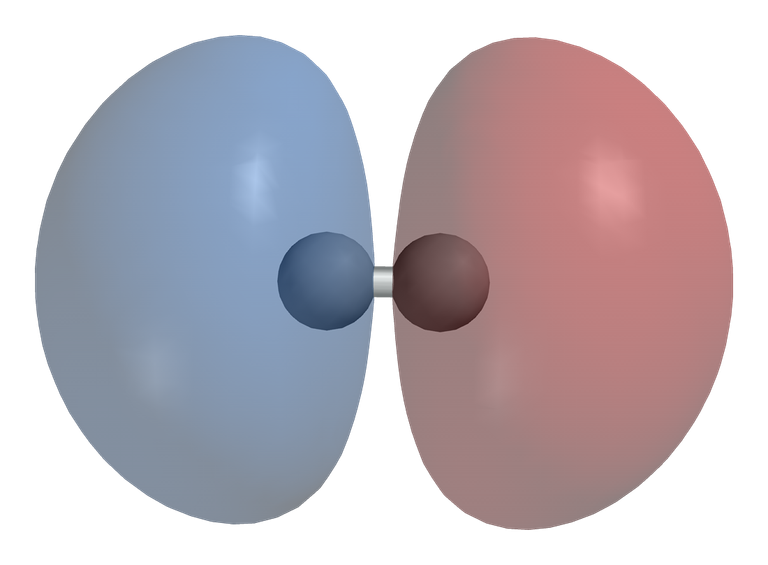
Orbital molecular de antienlace. Fuente de imagen
Con los orbitales p ocurre igual que con los s, los electrones se traslapan formando OM de enlace sigma o de antienlace. Los orbitales s y p se pueden traslapar entre sí.
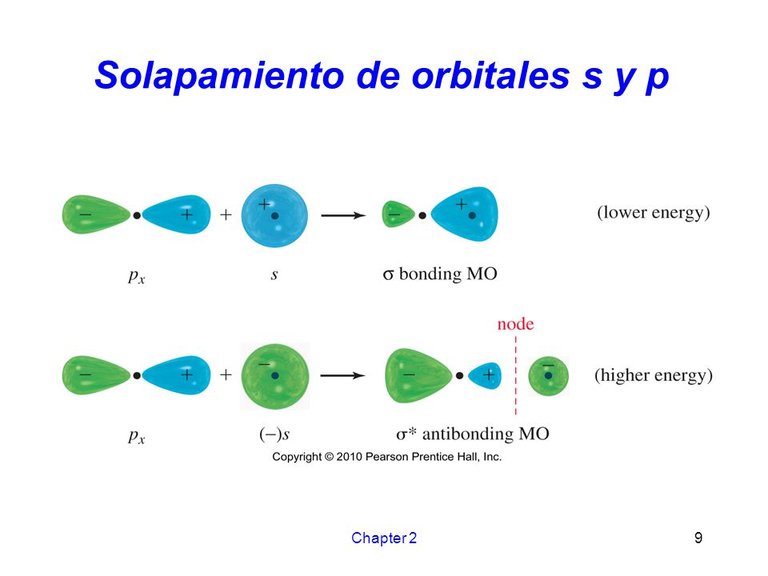
Solapamiento de orbitales s y p. Fuente de imagen
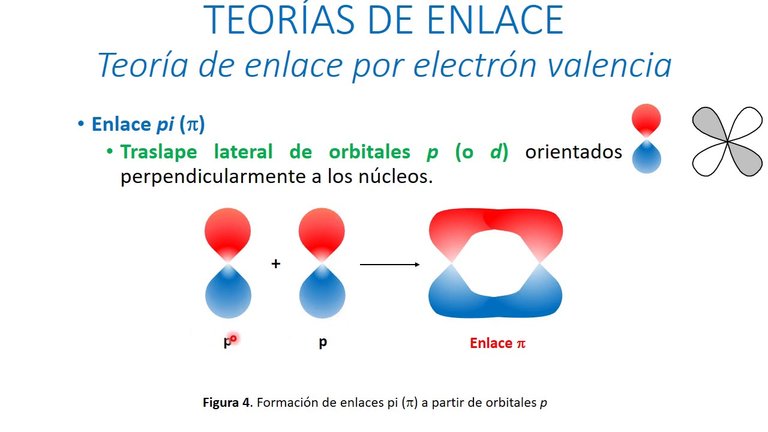
Enlace pi:
Un enlace pi es el resultado del traslape de dos orbitales orientados perpendicularmente a la línea que conecta los núcleos. Estos orbitales paralelos se traslapan lateralmente, y la mayor parte de la densidad electrónica se centra arriba y debajo de la línea que conecta a los núcleos. Un enlace doble requiere la presencia de cuatro electrones en la región de enlace entre los núcleos. El primer par de electrones entra en el OM de enlace sigma y forma un enlace sigma fuerte. El segundo par de electrones no puede ir en el mismo orbital o en el mismo espacio. Entra en un OM de enlace pi, con la densidad electrónica centrada arriba y debajo del enlace sigma.
Hibridación y formulas moleculares:
Los ángulos de enlace de los compuestos se pueden explicar mediante la teoría de repulsión de los pares de electrones de la capa de valencia (TRPECV). En esta teoría los pares libres se repelen entre sí, formando el mayor ángulo de separación posible entre ellos. Pero esta no es la única forma en que los átomos se repelen:
Hibridación sp:
Cuando un orbital s se suma a otro orbital p da como resultado dos orbitales sp, concentrando su densidad electrónica de un lado del ángulo, este es de conformación lineal (180 grados)

Hibridación sp lineal. Fuente de imagen
Hibridación sp2:
Formado por un orbital s y dos p forman ángulos de 120 grados, conocidos como geometría trigonal, que da como resultado 3 orbitales sp2.
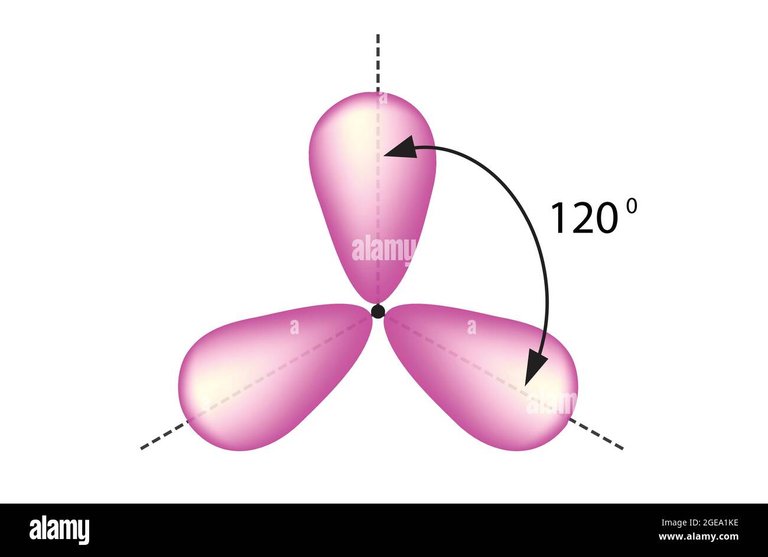
Hibridación sp2 trigonal. Fuente de imagen
Hibridación sp3:
Formado por un orbital s y tres p da como resultado cuatro orbitales híbridos sp3, con ángulos de 109,5 grados conocido por arreglo tetraédrico.
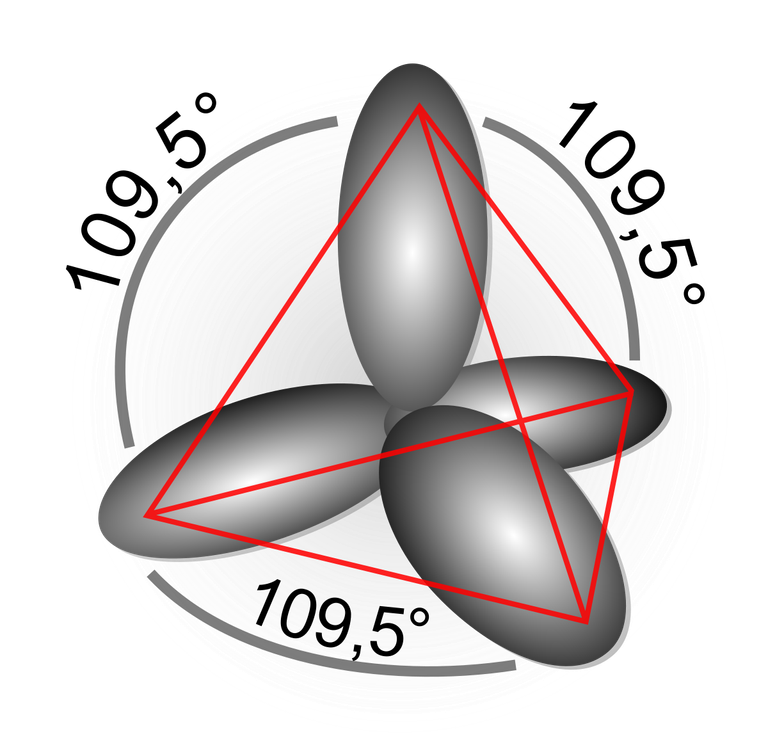
Hibridación sp3 tetraédrica. Fuente de imagen
Como dibujar moléculas tridimensionales:
Emplear la perspectiva es difícil cuando una molécula es grande y complicada. En química orgánica se ha desarrollado una notación abreviada para simplificar los dibujos tridimensionales. Las líneas punteadas indican enlaces que van hacia atrás, alejándose del lector. Las líneas en forma de cuña representan enlaces que van hacia fuera, en dirección del lector. Las líneas rectas son enlaces en el plano de la página.
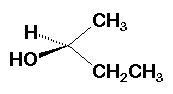
Líneas discontinuas y cuñas. Fuente de imagen
Rotación de enlaces:
Cuando un compuesto tiene enlaces simples puede rotar sobre su carbono, cuando un compuesto difiere en la posición de los enlaces con respecto a otro se le conoce como conformaciones, los enlaces doble no pueden rotar porque el movimiento rompería su estabilidad.
Isomería:
Este concepto abarca a las diferentes formas de ubicar espacialmente una molécula, más adelante hablare sobre ella a profundidad pero de momento que conozcan las más importantes.
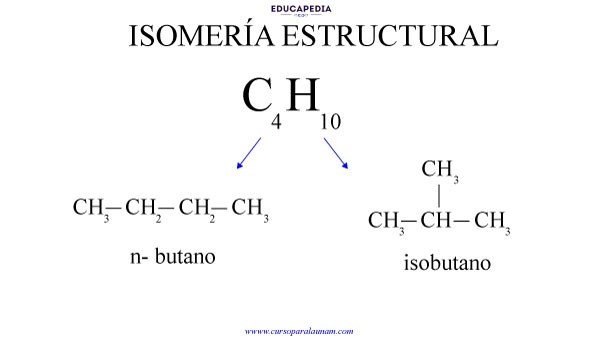
Isomería constitucional o estructural:
Consiste en compuestos de misma fórmula molecular pero de diferentes orientaciones espaciales, también pueden diferir en un doble enlace, un grupo o por tener un anillo.
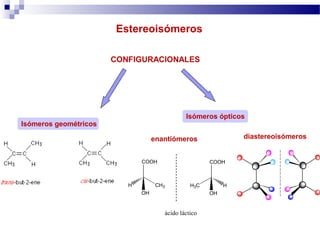
Estereoisomeros:
Estos tienen el mismo orden de enlace pero difieren en su orientación espacial, los isómeros cis-trans conocidos también por isómeros geométricos ya que difieren en la geometría de los grupos de un enlace doble tienen que tener grupos distintos a los lados del doble enlace.
Fuerzas intermoleculares:
Cuando unas moléculas se aproximan se atraen o se repelen entre si, estas atracciones son muy importantes en sólidos y líquidos ya que están en contacto constante, existen tres tipos de fuerzas de atracción:
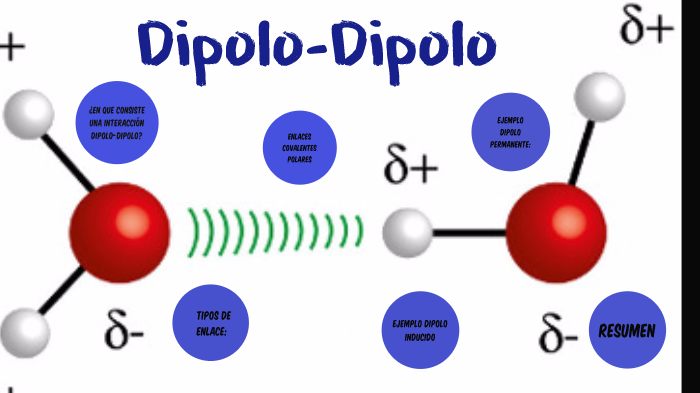
Fuerzas dipolo-dipolo:
La mayoría de molécula tienen un polo positivo y uno negativo, en el punto en que el polo positivo de una se sienta atraído por el negativo de otra se forman interacciones permitiendo la estabilidad del compuesto.
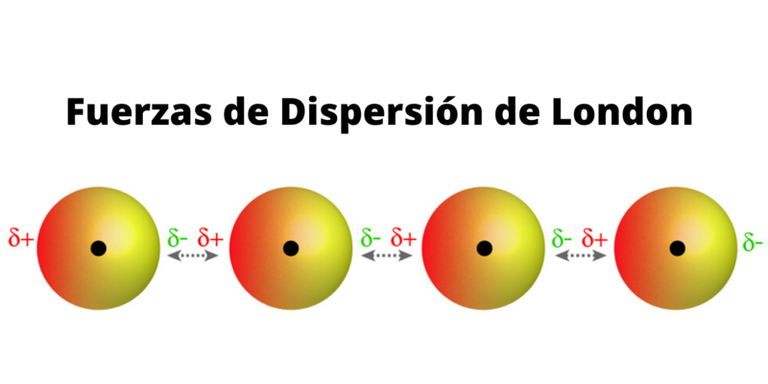
Fuerzas de dispersión de London:
Aunque una molécula no tenga polaridad fija el continuo movimiento de enlaces y la influencia de otros compuestos origina momentos positivos y negativos, que cuando interactúan entre si dan lugar a un tipo de atracción dipolo-dipolo, estos momentos dipolo cambian constantemente, pero están correlacionados por lo que la fuerza es de atracción, esto depende del superficial cercano de dos moléculas, por lo que es proporcional al área superficial molecular.
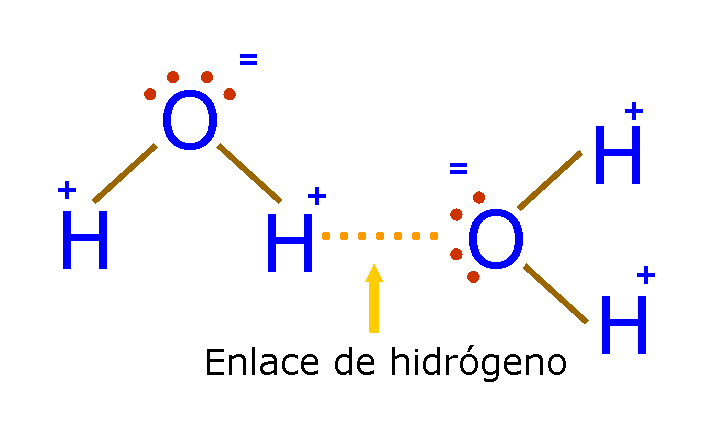
Enlace por puente de hidrogeno:
Esto no es un enlace como tal pero si una atracción dipolo-dipolo fuerte, suelen formarse en enlace de H-O y H-N, como el O y el N son particularmente electronegativos dejan al H con una carga parcial positiva mayor, formando lo conocido como puentes de hidrogeno con O o N de otras moléculas que se encuentren en contacto constante.
Efecto de la polaridad sobre la solubilidad:
Semejante disuelve a semejante, osea, una sustancia polar disuelve a una polar y la apolar a apolar.
Este post sería el último a modo de introducción, en el siguiente hablaré sobre los alcanos, el hidrocarburo más simple. Espero les haya gustado el contenido y servido de algo, comenten inquietudes y voten si les gustó.
- Basado en el Wade Leroy G. Química Orgánica.