En esta primera publicación quiero tratar lo básico que se necesita saber sobre química para introducirse en el estudio de la orgánica, para ello veremos los siguientes temas.
¿Qué es la química orgánica?
La química orgánica es la rama de la química que se centra en las diferentes interacciones del carbono con los elementos de la naturaleza, siendo este el elemento principal de la orgánica. Esta se utiliza en la producción de fármacos, medicamentos, plásticos, pesticidas, pinturas y fibras. Muchos de los avances médicos más importantes son en realidad avances en la química orgánica.
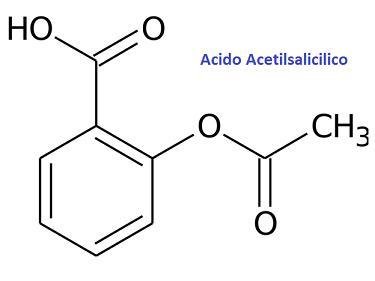
Compuesto de la aspirina, medicamento que se sintetiza con el uso de la orgánica. Fuente de imágen
Estructura atómica
Los átomos están formados por protones, neutrones y electrones. Los protones tienen carga positiva y se encuentran junto con los neutrones (sin carga) en el núcleo. Los electrones, los cuales tienen una carga negativa de igual magnitud a la carga positiva del protón, ocupan el espacio que rodea al núcleo. Los electrones son los que participan en las reacciones y formaciones de enlaces, los protones dan lugar al número atómico y los elementos con iguales protones pero diferentes neutrones se les conoce como isotopos.
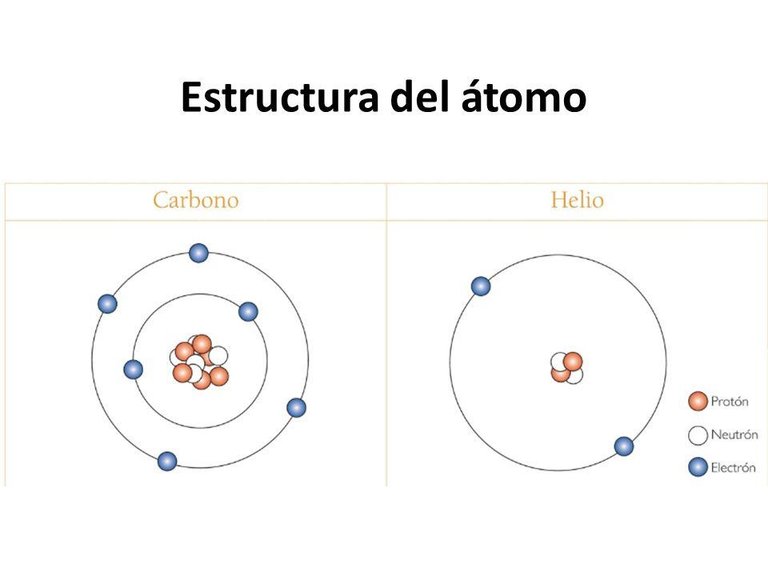
En este ejemplo vemos la estructura atómica del carbono y del helio, con sus electrones en órbita y los protones y neutrones en el centro. Fuente de imágen
Regla del octeto
Los elementos en la naturaleza buscan la estabilidad electrónica, que sólo se lograría con la configuración electrónica de un gas noble, a este suceso se le conoce como la regla del octeto porque una capa llena de electrones en el segundo nivel consta de ocho electrones. Existen dos formas en la que los átomos pueden interactuar para cumplir esta regla, mediante la transferencia de electrones de un átomo a otro, conocido como enlace iónico o compartiendo enlaces, conocido como enlace covalente.
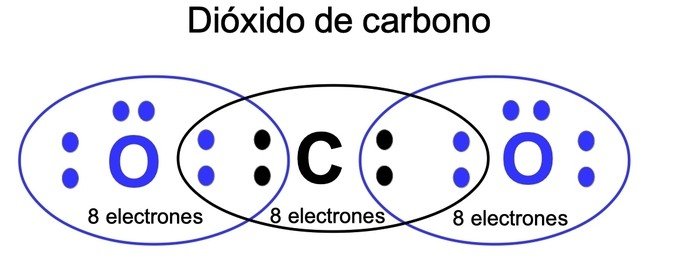
En el CO2 el C y el O cumplen esta regla. Fuente de imágen
Enlace iónico:
Veamos el ejemplo del Na y el Cl, el Na tiene un electrón de más que su configuración más estable, la del Ne, y al Cl le falta un electrón para llegar a su configuración más estable, el Ar, al Na darle un electrón al Cl este se queda con carga positiva y el Cl con carga negativa, haciendo que se atraigan mutuamente y formando un enlace iónico. Este tipo de enlace es muy común en compuestos inorgánicos.
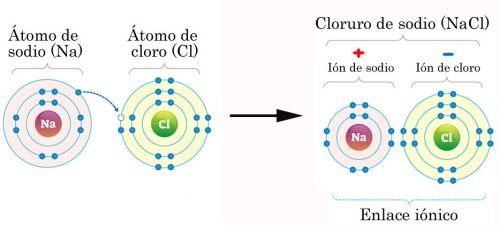
Sodio donando un electrón al cloro. Fuente de imágen
Enlace covalente:
Este enlace es más común en compuestos orgánicos, en el caso del hidrógeno, este necesita un electrón para alcanzar la configuración del helio, y al juntarse con otro hidrógeno comparten sus electrones a través del enlace covalente.
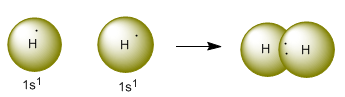
Hidrógenos logrando la configuración del gas noble. Fuente de imágen
Estructura de Lewis
Las estructuras de Lewis es una forma de plasmar los enlaces covalentes, consiste en representar un electrón de valencia con un punto y un par de electrones con dos puntos o un guión, de tal forma que cumplan la regla del octeto. Los electrones no enlazados son electrones de la capa de valencia que no se comparten entre dos átomos. Los átomos de oxígeno, nitrógeno y halógenos (F, Cl, Br, I) generalmente tienen electrones no enlazados en sus compuestos estables.
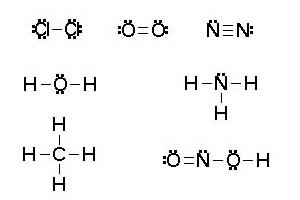
Ejemplo de diferentes estructuras de Lewis. Fuente de imágen
Enlaces múltiples
En los casos que una molécula comparte dos o tres pares de electrones dejan de formar enlaces simples, formando dobles o triples enlaces.
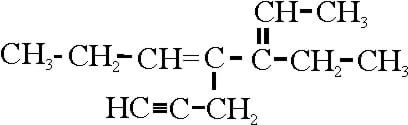
Ejemplo de un compuesto con diferentes tipos de enlaces. Fuente de imágen
Electronegatividad y polaridad del enlace
Cuando una molécula tiene los electrones compartidos de manera equitativa se le conoce como enlaces covalentes no polares, que en la mayoría de los casos están dados por las mismas moléculas, cuando dos moléculas diferentes forman un enlace una hala los electrones con más fuerza que otra, cuando los electrones están compartidos de forma desigual se le conoce como enlace covalente polar. En los enlaces covalentes polares una molécula tiene carga parcial positiva (+) y otra parcial negativa (-), para predecir cuál es más negativa se usa la electronegatividad, que asciende de izquierda a derecha en la tabla periódica, siendo el elemento más electronegativo el de carga parcial negativa.
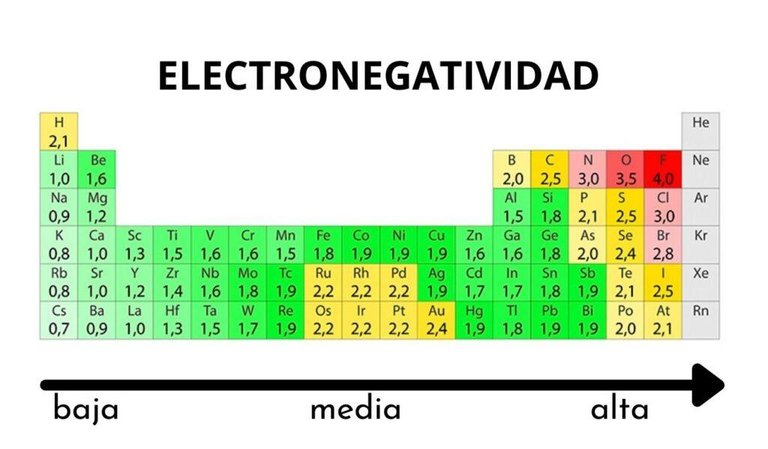
Tabla periódica donde se aprecia la electronegatividad de los elementos. Fuente de imágen
Cargas formales
La carga formal de un átomo nos permite dar seguimiento a los electrones y comprobar la
estabilidad de la molécula (una molécula es estable con carga formal=0), esta se calcula con la siguiente formula:
Carga Formal = Numero de grupo – electrones no enlazados – ½ electrones compartidos.
Estructuras iónicas
Los enlaces iónicos se utilizan en casos donde un átomo no pueda enlazarse de manera covalente a otro para no exceder su capa de valencia y cuando la diferencia de electronegatividad es muy grande, lo que es conocido como estructuras iónicas.
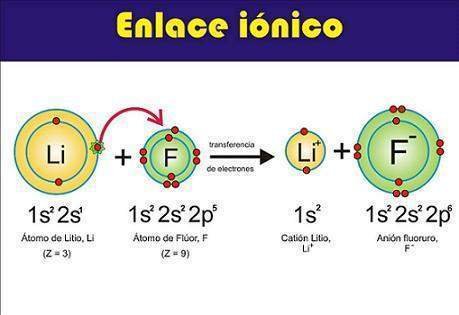
Estructura ionica del LiF (fluoruro de litio) Fuente de imágen
Resonancia
La resonancia consiste en las diferentes formas de representar un compuesto, se dice que una sustancia no es una u otra forma resonante sino un híbrido de ambas. Entre estas formas híbridas existen unas más estables que otras, a la más estable se le conoce como contribuyente principal y a la menos estable contribuyente secundario. Para lograr una estructura resonante se debe dibujar todas las colocaciones de electrones posibles, sin alterar la posición de los elementos.
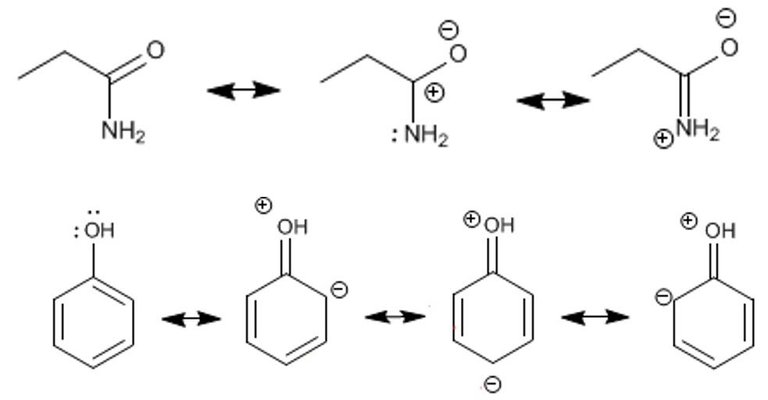
Formas de resonancia. Fuente de imágen
Ácidos y bases
A lo largo de la historia, en la química se le atribuyeron a los ácidos y bases tres teorías
principales:
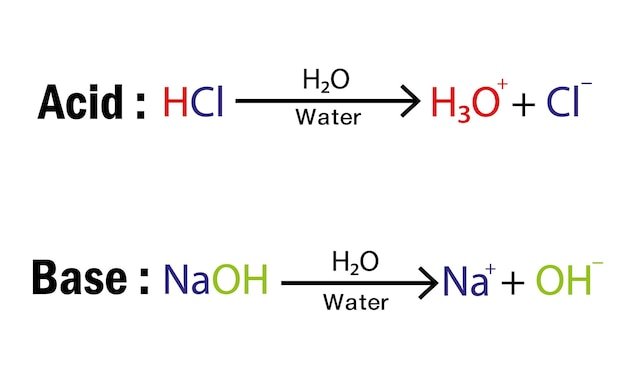
Arrhenius:
Definió a los ácidos como sustancias que se disocian en agua para formar iones H30+ y
a las bases como sustancias que se disocian en agua para formar iones hidróxido.
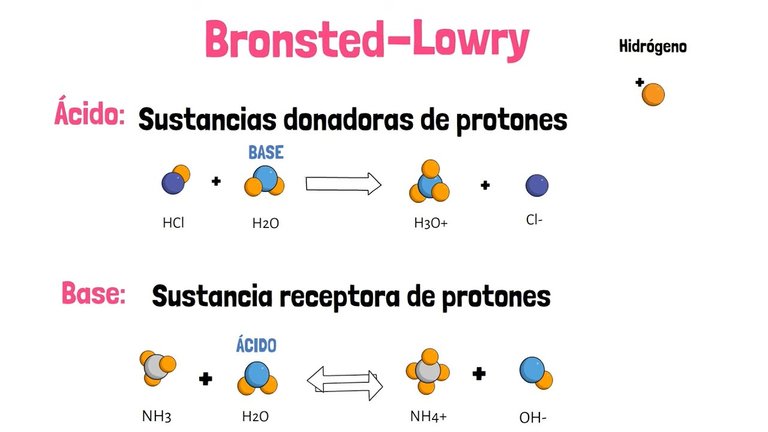
Bronsted-Lowry:
Definió a los ácidos como cualquier especie que puede donar un protón, y a las
bases como cualquier especie que puede aceptar un protón.
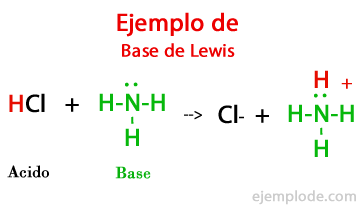
Lewis:
Definió a los ácidos como especies que pueden aceptar electrones (electrófilos, amante de electrones) y a las bases como especies que pueden donar electrones (nucleófilos, amante de núcleos), las flechas curvas se usan para mostrar el flujo de electrones.
Espero y les haya gustado, y sobre todo les fuera de utilidad, cualquier recomendación o criterio sobre el contenido los leo en los comentarios.
- Basado en el Wade Leroy G. Química Orgánica.