Casi todas las sustancias valiosas de algún modo para la humanidad se encuentran presentes en la naturaleza formando mezclas, que contienen no solo los componentes deseados sino también otros que consideramos impurezas, basta con mencionar por ejemplo el petróleo crudo, los productos valiosos son los diferentes hidrocarburos que lo componen y que son utilizados principalmente como combustibles, por lo que se necesitan diferentes operaciones para separar estos hidrocarburos entre ellos, a lo que solemos llamar refinación del petróleo. Y para llevar a cabo esta refinación, o purificación en el caso de cualquier líquido, el método más empleado es la destilación, en alguna de sus dos variaciones, simple o fraccionada.
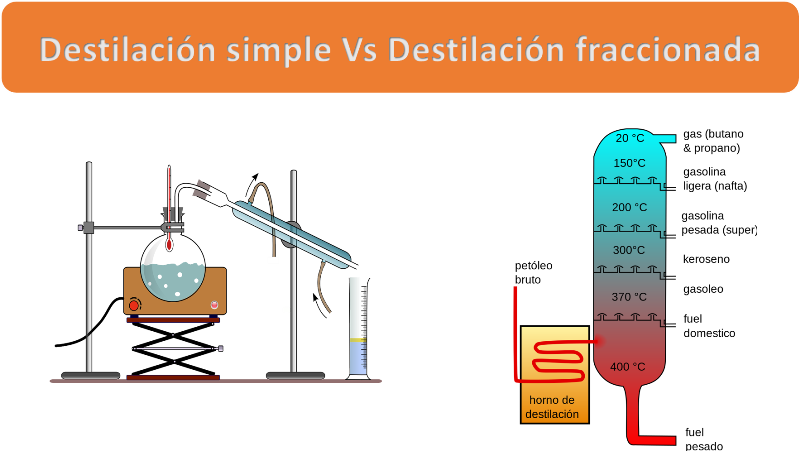
La destilación, en sus dos tipos, es el método más empleado de separación. Fuente: elaborado por @emiliomoron con las imagenes de dominio público de un aparato de destilación simple y el esquema de una torre de fraccionamiento.
Este proceso de separación denominado destilación se basa en el equilibrio entre las fases vapor y líquido, esencialmente a la misma temperatura y presión para las zonas que coexisten. En general, para ambos tipos de destilaciones el proceso es el mismo, se trata de someter la mezcla de alimentación a un proceso de calentamiento para que los componentes con los puntos de ebullición más bajos vaporicen primero, el vapor de las sustancias puras se separa y se enfría para obtener el destilado.
En base a este principio es fácil entender que la relación entre la temperatura y la vaporización es lo fundamental para entender tanto el principio de la destilación. Como bien sabemos, cuando un líquido se encuentra en un recipiente abierto la atmosfera ejerce presión sobre la superficie del líquido, esta presión contrarresta la presión de vapor del líquido. Pero a medida que la temperatura del recipiente aumenta, también lo hace la energía cinética de las moléculas del líquido en su interior, lo que hace que más moléculas logren escapar a la fase vapor, lo que provoca un aumento de la presión de vapor. La ebullición se produce cuando el líquido ha alcanzado una temperatura que le permite a las moléculas evaporarse libremente, igualando la presión de vapor del líquido a la presión atmosférica en esta condición.
Destilación simple
Cuando los distintos componentes que conforman la mezcla líquida tienen diferentes puntos de ebullición, a cualquier temperatura estos también tendrán diferentes presiones de vapor; así, si por ejemplo calentamos una solución de varios compuestos en un recipiente cerrado, el vapor generado y contenido en el recipiente mantendrá esta diferencia, solo que este vapor tendrá más moléculas de los compuestos más volátiles y menos moléculas de los compuestos con menor presión de vapor.
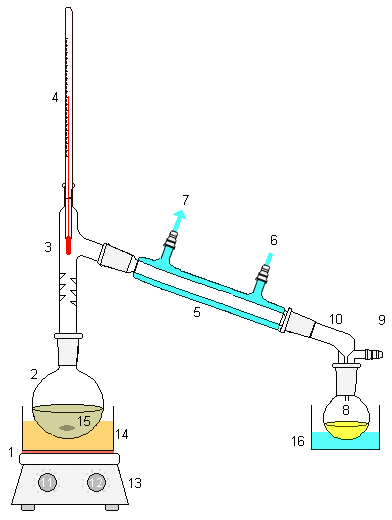
Montaje de un sistema de destilación simpple. Fuente: Wikipedia.com.
Si por ejemplo, tenemos una solución de dos líquidos, A y B, completamente miscibles, y uno de ellos tiene una temperatura de ebullición muy alta con respecto al otro, ese compuesto estará prácticamente ausente en el vapor, mientras que, por otro lado, el líquido residual contenido en el recipiente tendrá una composición más rica en el compuesto menos volátil. Vamos a verlo con el diagrama de equilibrio líquido-vapor a presión constante.
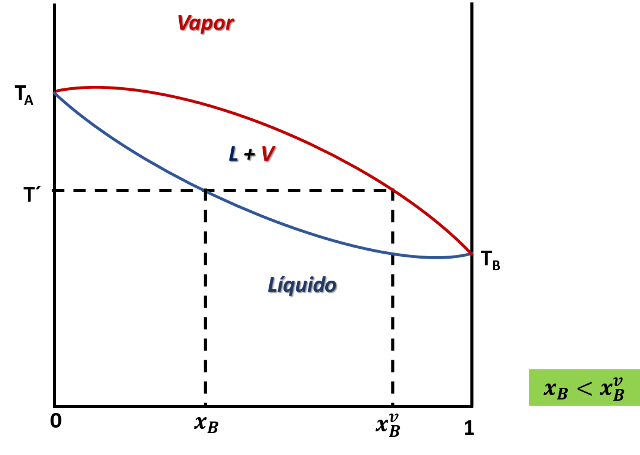
Diagrama de equilibrio líquido-vapor para una mezcla binaria que forma una disolución ideal. Fuente: imagen elaborada en powerpoint.
Como podemos apreciar en el diagrama, si una solución de composición xB se calienta hasta la temperatura T´, se produce un vapor con una composición xvB dada por el corte de la isoterma con la línea de equilibrio, el cual esta enriquecido con el componente B, el más volátil.
Entonces, la destilación simple consiste en recoger ese vapor que ahora tiene una concentración más elevada en el componente B, hacerlo pasar por un condensador para que se enfríe, y luego condense en un nuevo líquido. La destilación simple separa los dos componentes de esta mezcla porque el líquido condensado tiene una mayor proporción del compuesto con menor punto de ebullición mientras que el líquido de partida se va enriqueciendo con el compuesto con mayor punto de ebullición.

A la salida del condensador se recoge el destilado rico en el componente más volatil. Fuente: pixabay.com.
Destilación fraccionada
Ahora bien, como nos podemos dar cuenta, con la destilación simple no se logra una separación completa, y si la solución contiene líquidos con puntos de ebullición cercanos, este proceso se complica, por ejemplo, si deseamos separar una solución de agua y etanol.
El etanol tiene un punto de ebullición de 78 °C, es muy cercano a la temperatura de ebullición del agua, así que, cuando se calienta la mezcla, el etanol hierve primero a los 78 °C, pero es inevitable que también se evapora una cantidad importante de agua, evitando extraer el etanol puro.
Para lograr una separación casi completa debemos recoger el vapor formado, condensarlo, y devolverlo a un equipo de destilación; repitiendo este proceso hasta lograr grados de separación más altos. Pues bien, la destilación fraccionada resuelve este problema mejorando el grado de separación en un solo proceso, y para ello necesitamos una columna de fraccionamiento.
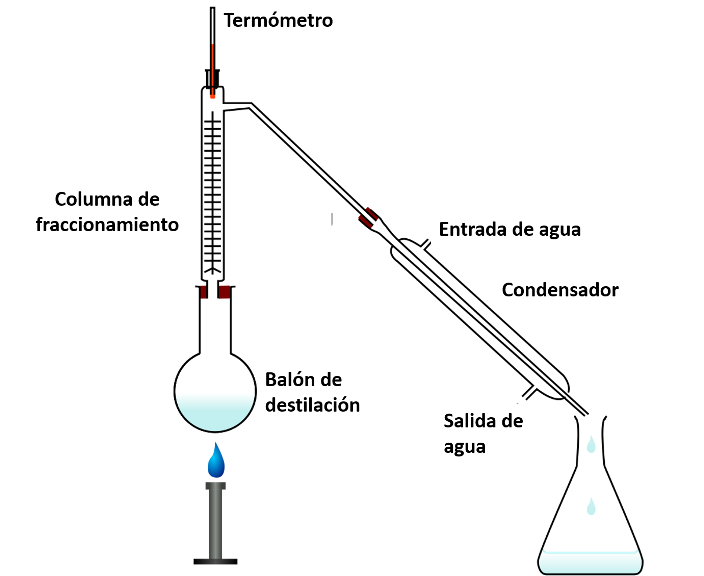
Aparato de destilación fraccionada. Fuente: Wikipedia.com.
En la columna de fraccionamiento el líquido destilado condensa y se vaporiza repetidas veces al subir por la columna, y en cada vaporización, se va consiguiendo mayor grado de separación, enriqueciendo el destilado en los componentes más volátiles. Vamos a esquematizar este proceso con el diagrama de equilibrio líquido-vapor para una mezcla binaria de dos líquidos miscibles, A y B.
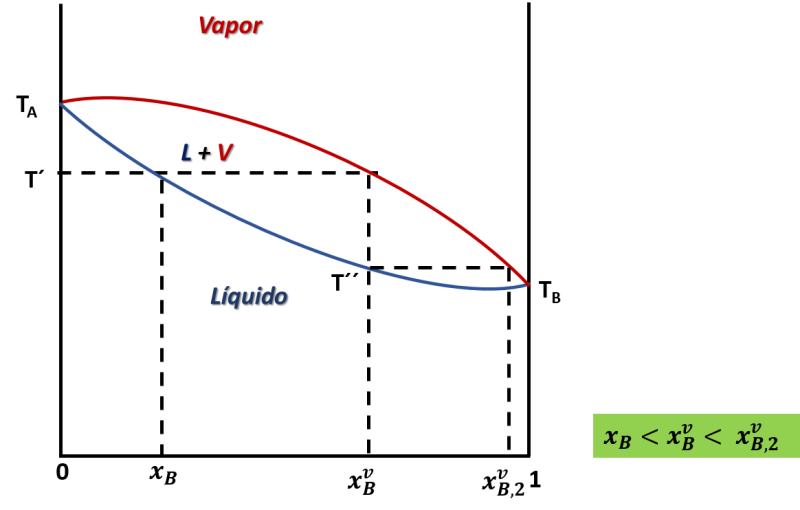
Diagrama de equilibrio líquido-vapor para una mezcla binaria, con revaporización de la mezcla. Fuente: imagen elaborada en powerpoint.
Como vemos en el diagrama, al calentar isobáricamente el sistema de composición xB hasta la temperatura T´, el primer vapor formado tiene la composición xvB, si extraemos ese vapor y se condensa, el líquido tendrá una composición igual a xvB, y si volvemos a calentar ese líquido, a la temperatura T´´ se obtendrá un nuevo vapor ahora con composición inicial xvB,2; y como vemos, con la vaporización y revaporización sucesiva de la mezcla podemos llegar a separar ambos líquidos, y a cada etapa de vaporización se dice que corresponde a un plato teórico de la columna.
Múltiples evaporaciones una sola columna
Básicamente la principal diferencia entre la destilación simple y la destilación fraccionada es la colocación de la columna de fraccionamiento entre el equipo donde se caliente la mezcla y el lugar donde se recoge el vapor.

Columna de destilación fraccionada. Fuente: wikipedia.com.
Esta columna suele estar llena de materiales metálicos o perlas de vidrio que denominamos empaques, y lo que hacen es ofrecer mayor área superficial para favorecer la condensación, y a medida que los vapores ascienden sobre la columna se condensan sobre las superficies más frías de estos materiales, luego, los vapores calientes que ascienden por la columna vuelven a evaporar este líquido, condensando de nuevo, y así sucesivamente. Y con cada evaporación se tiene como resultado un vapor con una mayor proporción de moléculas del líquido con menor punto de ebullición, consiguiendo así mayor separación que con una única etapa de vaporización, y con menos pérdida de líquidos que si se llevaran a cabo varias rondas de destilación simple.
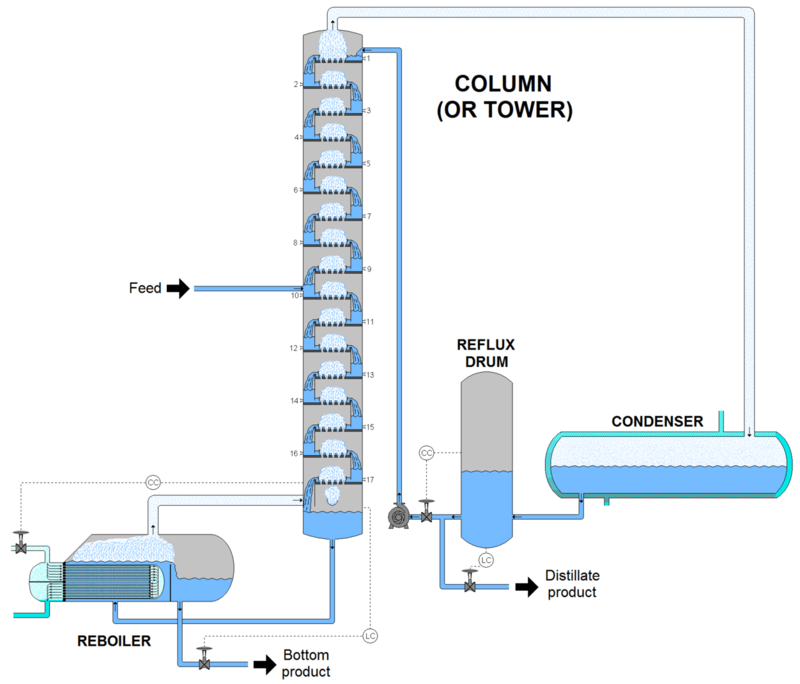
Esquema de una torre de fraccionamiento. Fuente: Wikipedia.com.
En la imagen anterior podemos observar el esquema de una columna de fraccionamiento a nivel industrial, con el arreglo tipico de platos donde se produce la vaporización y condensacion sucesiva en cada etapa.
Bueno amigos espero les haya gustado la descripción de estas dos variantes del proceso de separación de líquidos que denominados destilación. ¡Hasta la próxima!
Referencias
Wikipedia.com. Columna de fraccionamiento
Maron & Prutton (2006). Fundamentos de fisicoquímicada. Editorial Limusa.
Levine, I. (2004). Fisicoquímica. Editorial McGraw Hill.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
Gracias amigos!
Your content has been voted as a part of Encouragement program. Keep up the good work!
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for new Proposal
Delegate HP and earn more
Thanks!