
Autor: @madridbg, a través de Power Point 2010, utilizando imágenes de dominio público.
Saludos estimados miembros de la plataforma #hive, continuando con el proceso de socialización de los proceso químicos aplicados a escala industrial, en esta oportunidad estudiaremos lo referente al equilibrio que deben prevalecer en las reacciones químicas, para ello enfocaremos nuestro estudio en el proceso HABER como mecanismo industrial utilizado en la producción de amoniaco.
Como ha sido constante en mis publicaciones este tipo de material lo compartiremos a trves de la plataforma de las comunidades @stemsocial, @stem-espanol y @cervantes, comunidades pioneras en tema de interés científico con aportaciones prácticas.
INTRODUCCIÓN
Las reacciones químicas son procesos que están presentes en todos los sistemas que conforman nuestra vida, desde los aspectos biológicos, hasta los metabólicos, se rigen por principios químicos asociados a las reacciones. Por consiguiente, es de suma importancia conocer el mecanismo de acción de estos sistemas, los cuales responden a cabalidad a tres interrogantes que describiremos a continuación.
1. ¿Qué es lo que sucede cuando se produce una reacción química?
2. ¿Qué delimita la rapidez de una reacción química?
3. ¿Hasta dónde puede llegar una reacción química?
Ante de responder a esta interrogante, es preciso recordar y diferenciar los términos reacciones químicas y ecuaciones químicas, donde las primeras es el proceso que se lleva a cabo cuando los reactivos interactúan para generar sustancias diferentes a las de su constitución inicial, por su parte, la segunda no es más que una representación que podemos realizar en papel y que nos permite comprender el funcionamiento del proceso real.
En este sentido y en función de lo anterior, podemos establecer que la respuesta a la primera interrogante, no las proporcionan los proceso estequiométricos, entiéndase como la relación cuantitativa entre reactivos y productos, por tanto lo que sucede es la interacción de cantidades de sustancia para formar nuevos productos.
En función al planteamiento número dos, podemos establecer que la rapidez es sinónimo de cinética, la cual nos permite visualizar el comportamiento de las partículas en función del tiempo. En este sentido, dejaremos el planteamiento número tres para darle respuesta a lo largo de este artículo el cual nos permitirá reforzar y comprender el funcionamiento del proceso HABER en la síntesis de amoniaco.
GENERALIDADES SOBRE EL EQUILIBRIO QUÍMICO
Al hablar de equilibrio químico, tenemos que asociarlo con la capacidad que manifiestan los procesos químicos, donde las concentraciones de los reactivos en comparación con las concentraciones de los productos son constantes a lo largo del tiempo.
Un ejemplo de este proceso, podemos visualizarlo cuando colocamos una recipiente con agua el cual taparemos y colocaremos a hervir, a medida que pasa el tiempo podemos observar que se forman un conjunto de burbujas en forma de vapor de agua, las misma intentar salir del recipiente pero gracias a la tapa no lo logran y terminan regresando al mismo.
Cuando la cantidad de partícula que intentan salir, igualan a las que regresan al recipiente, podemos establecer que nos encontramos en un equilibrio dinámico. Lo mismo ocurre con las reacciones en equilibrio, parte de los reactivos se agotan para forma nuevos productos y estos a su para regenerar los reactivos, llega un punto que el proceso no avanza ya que hemos alcanzado un equilibrio en la reacción química y en función a nuestra necesidades este equilibrio podemos manipularlos hacia la derechas es decir formación de productos o hacia la izquierda regeneración de los reactivos.
De tal manera que cuando las velocidades de las reacciones se igualan, las concentraciones de reactivos y productos permanecen constantes y el sistema ha entrado en equilibrio. A nivel biológico este comportamiento es fundamental, como ejemplo podemos citar el transporte de oxigeno por parte de la hemoglobina, donde la reacción debe estar en equilibrio o nuestro sistema se colapsaría por la falta o abundancia de oxigeno hasta los diferentes órganos que componen nuestro cuerpo.
El proceso responde a la siguiente ecuación:
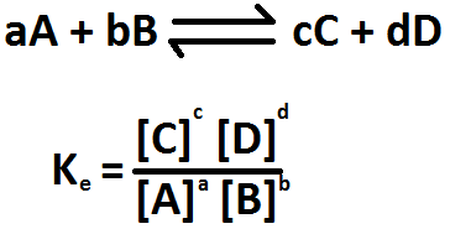
Fig. 2. Representación de la constante de equilibrio. Autor: Norabermudez
Si analizamos la ecuación, nos damos cuenta que para lograr el equilibro, debemos relacionar la concentraciones de los productos en función de las concentraciones de los reactivos, el cual nos permitirá determinar la constante de equilibrio del sistema. De igual forma debemos tomar en cuenta que en su mayoría todas las reacciones químicas tienden hacer reversible.
MÁS ALLÁ DE LA CONSTANTE DE EQUILIBRIO
En el apartado anterior, hicimos una revisión previa sobre la constante de equilibro, donde pudimos observar que esta depende de las concentraciones en equilibrio tanto de los reactivos como de los productos, en donde la misma variable que hoy denominamos contantes de equilibrio solo se encuentra en forma constante cuando la temperatura del sistema no cambia.
En este sentido, a través de la ecuación podemos predecir diferentes comportamientos de un proceso químico, gracias al dinamismo e interpretación que se le puede dar a la representación cuantitativa. De tal manera, que a través de ella podemos observar la dirección de la ecuación química.
Por otra parte, la misma ecuación nos permite determinar las concentraciones de las sustancias en equilibrio a partir de la constante en equilibrio un ejemplo de este proceso lo podemos determinar en el siguiente enunciado:
Ejercicio propuesto:
La formación del trans-estilbeno se lleva a cabo mediante el cis-estilbeno a una concentración de 0,850mol/l. si el proceso se lleva a cabo en a 200°C y la constante de equilibrio es de 24. Determine las concentraciones del cis y trans-estilbeno.
Para responder a estos planteamientos debemos seguir la siguiente secuencia
Paso 1. Extraer los datos que nos proporciona el enunciado.
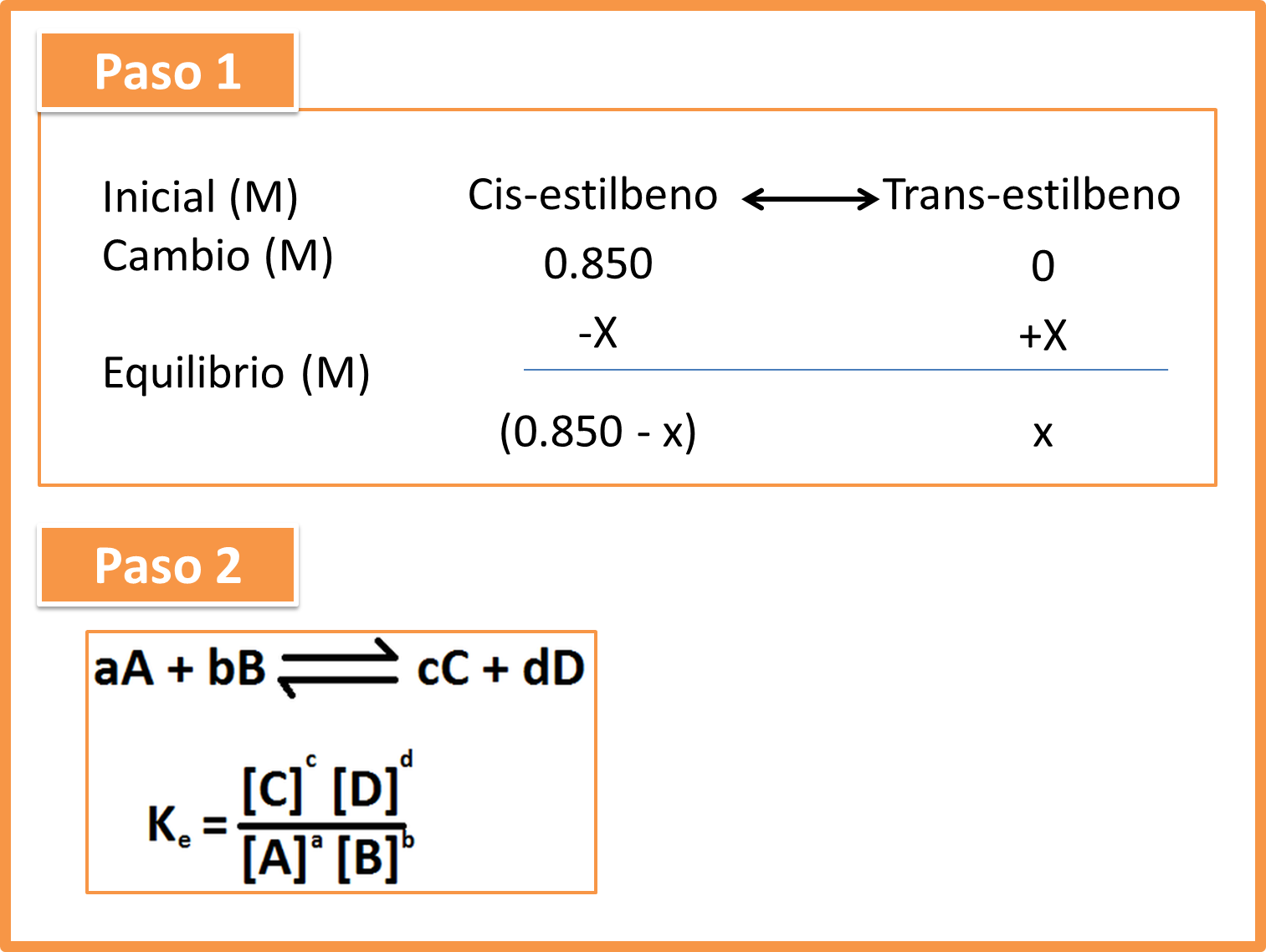
Fig. 3: Pasos 1 y 2 en la resolución del problema . Autor: @madridbg, a través de Power Point 2010.
Paso 2. Ubicar el camino o vía que nos permite llegar a la solución del problema, en este caso será la ecuación que corresponde a la secuencia en equilibrio.
Paso 3. Sustituir los valores y aplicar los procesos matemáticos correspondientes.

Fig. 4: Pasos 3 y 4 en la resolución del problema . Autor: @madridbg, a través de Power Point 2010.
Como podemos observar en las imágenes anteriores, mediante la ecuación de equilibrio podemos determinar la concentración de las sustancias participantes.
EL PROCESO HABER COMO MECANISMO TECNOLÓGICO ASOCIADO AL EQUILIBRIO QUÍMICO
A nivel industrial es de suma importancia conocer los factores que afectan el equilibrio de una reacción, ya que la manipulación de estos nos permite obtener resultados eficaces sobre el proceso que se esté desarrollando. En este sentido, el proceso Haber, es aquel que se utiliza en la síntesis de amoniaco, el mismo permite una reacción química entre las moléculas de hidrógeno y el nitrógeno gaseoso, reacción que se ve catalizada por aceleradores heterogéneos.
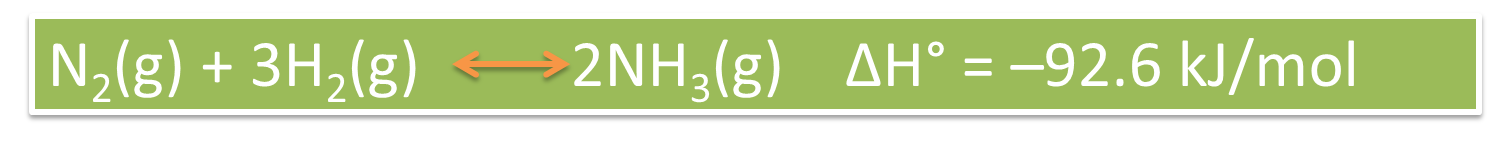
Fig. 5: Ecuación química que representa la síntesis del amoniaco. Autor: @madridbg, a través de Power Point 2010.
Si analizamos la ecuación podemos establecer por estequiometria que 1 mol de nitrógeno reacciones con 3 moles de hidrógeno y producen 2 de amoniaco, sin embargo, si observamos la variación de la entalpÍa, nos damos cuenta que la reacción es exotérmica por lo que se lleva a cabo con una rapidez sorprendente lo que disminuye la eficiencia del proceso.
Ahora si queremos ser eficiente en la producción de amoniaco, deberíamos manipular la variable temperatura y utilizar la ecuación a bajos grados centígrados, el cual está comprobado genera un proceso más eficaz en rendimiento, pero más lento en la obtención, lo que a la larga desplaza el equilibrio de la reacción hacia el lados de los reactivos. De tal manera a nivel industrial se prefiere trabajar con el modo rápido, es decir, elevando la temperatura ya que las cantidades obtenidas por horas de producción son mayores y el desplazamiento del equilibrio tiende a estar del lado de los productos.
Por lo que podemos concluir que es preferible una producción comercial rápida a sabiendas que nos generara un mayor costo en el proceso, por esta razón el proceso tecnológico se lleva a cabo a levadas temperaturas y elevadas presiones lo que nos permite generar amoniaco a gran escala.
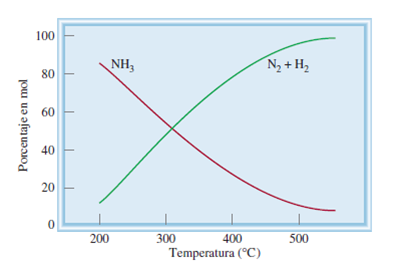
Fig. 6: Gráfico que demuestra la relación temperatura rendimiento en la obtención de amoniaco. Autor: @Chang, (2010).
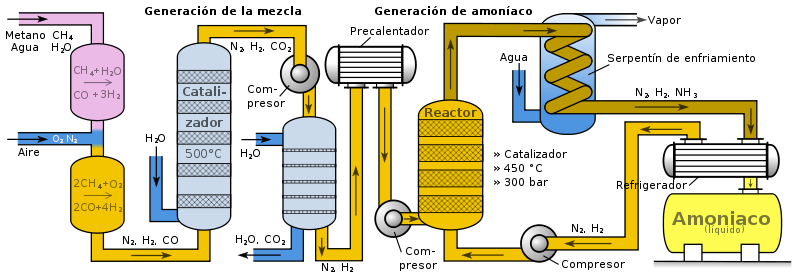
Fig. 7. Representación del proceso HABER. Autor: User:Sven
APORTES DE LA TEMÁTICA
A lo largo del desarrollo de esta publicación pudimos abordar lo relacionados con la constante de equilibrio que afecta a las reacciones químicas, de igual forma pudimos comprender la influencia de la cinética química sobre el comportamiento del equilibro, así como pudimos aplicar proceso cuantitativos para determinar las concentraciones de las sustancia que participan en una reacción química.
BIBLIOGRAFÍA CONSULTADA
[1] Chang, R. (2010). Química. Decima edicion. McGraw-hill Interamericana editores. ISBN: 978-607-15-0307-7.
[2] Estupiñan Silva, Rosmerlin Quesada, Benjamiín. (2010). El proceso Haber-Bosch en la sociedad agroindustrial: peligro y alternativas. Consejo Latinoamericano de Ciencias Sociales (CLACSO). Artículo: Acceso Online
[3] McMURRY E., John y Fay C., Robert. (2008). Química general. Quinta edición PEARSON EDUCACIÓN, México, 2009 ISBN: 978-970-26 1286-5.
[4] Ralph, H. Petrucci, William S. Harwood, E. Geoffrey Herring. (2003). QUIMICA GENERAL. Octava edición. PEARSON EDUCACIÓN. S.A., Madrid.
[5] WADE,LEROY. (2011). . QUÍMICA ORGÁNICA. VOLUMEN 2. SÉPTIMA EDICIÓN. PEARSON EDUCACIÓN, MÉXICO, 2011 ISBN: 978-607-32.()793•5. ÁREA: CIENCIAS
DE INTERÉS
Para más información relacionada con las áreas de ciencia, tecnología, ingeniería y matemáticas, no dudes en visitar #stemsocial y #stem-espanol, son comunidades que promueven avances científicos en estas áreas

#posh twitter:
Interesante publicación, las explicaciones son comprensibles, normalmente no es muy fácil entender el equilibrio químico.
Saludos @cryptoxicate, gracias por tu valioso comentario, es grato saber que nuestras publicaciones son percibida de buena forma por otros usuarios.
Congratulations @madridbg! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s) :
Your next target is to reach 40000 upvotes.
You can view your badges on your board and compare yourself to others in the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPSu post ha sido valorado por @ramonycajal
Gracias @ramonycajal por el valioso apoyo que realizan sobre mis trabajos.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.