Hola estimados Hivers, bienvenidos de vuelta a mi blog.
En esta entrega, volveremos con un contenido de carácter científico que nos permita profundizar los aspectos asociados con las reacciones químicas y sus implicaciones estequiometricas, en este sentido, es necesario comprender que los procesos químicos forman parte de nuestra existencia, de modo que están presenten en cada aspecto de nuestra cotidianidad.

Imagen cortesía de: OsloMetX
Por consiguiente, es de esperarse que estemos envueltos por múltiples procesos químicos que van desde los sistemas naturales hasta los diversos escenarios experimentales que hemos logrado establecer a nivel social, de allí la necesidad de generar un cumulo de conocimientos que nos permitan identificar el funcionamiento de la química detrás de cada aspecto que nos rodea.
En este sentido, podemos establecer que un proceso químico, no es más que aquel conjunto de fenómenos que se desarrollan con la interacción entre reactivos y productos. Los primeros responden a las sustancias que interaccionan y representan el punto de partida del fenómeno, además de ser las responsables de la producción de nuevas sustancias, denominadas productos que representan el punto final del proceso.
De manera que, durante las interacciones antes mencionadas, diversas variables están presenten y permiten controlar aspectos como la velocidad del proceso, así como las cantidades de las sustancias resultantes. Ahora bien, si deseamos comprender estos fenómenos a nivel de estudio, los científicos han logrado establecer modelos que permitan analizar la realidad en un proceso controlado, en el caso de las reacciones químicas, se desarrollan las ecuaciones que no es más que una representación que se realizan para poder comprobar la realidad resultante.
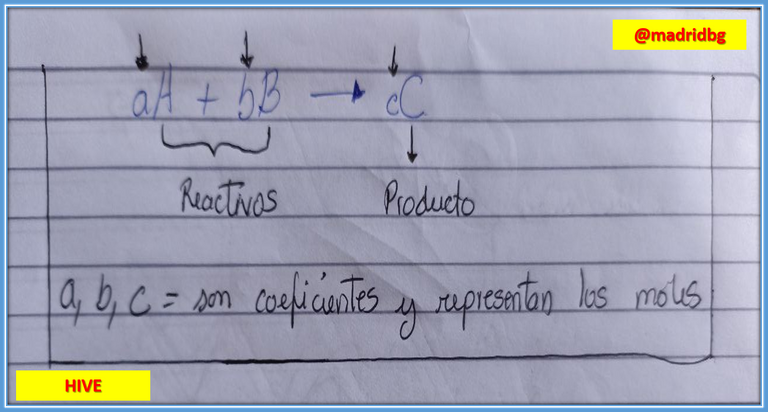
Partiendo de lo anterior, una ecuación química nos brinda información valiosa acerca del comportamiento de los reactivos y productos de manera que a través de los coeficientes de una ecuación balanceada podemos establecer los moles de las sustancias que participan, debemos conocer que un mol es una unidad química que equivale a una cantidad de partícula extremadamente grande (6.02*1023) que permita cuantificar las sustancias desde un nivel atómico a una escala macro matemáticamente hablando.
Además de ello, podemos establecer condiciones clara a nivel de las masas atómicas y del volumen que ocupan los materiales en condiciones ideales, sin embargo, a nivel experimental los planteamientos teóricos no se cumplen a cabalidad, es por ello que resulta imperante realizar conversiones basadas en unidades químicas para poder estar seguro de utilizar cantidades de sustancia (reactivos) adecuadas en función de los productos que deseamos obtener, proceso que podemos definir como principios estequiometricos.
Partiendo de lo anterior, apliquemos lo expresados.
Planteamiento propuesto:
Supongamos que tenemos 25 gramos de etileno y necesitamos saber cuántos gramos de HCl usar en la reacción. Si aplicamos los principios de los coeficientes en una ecuación balanceada, notaríamos que se necesitan un mol de HCl por cada mol de etileno. En este punto, para saber cuántos gramos de HCl se necesitan para que reaccionen con 25 g de etileno, primero habrá que determinar cuántos moles de etileno hay en esos 25 gramos.
Para ello, podemos implementar un factor de conversión o en su defecto utilizar el procedimiento de la regla de tres que nos permita determinar la masa molecular de etileno, de manera que haremos la conversión de gramos a moles a partir del cálculo de la masa molar de etileno, el cual nos permitirá aplicar la regla de tres correspondiente.

Partiendo del cálculo establecido en la imagen anterior podemos establecer una relación de sustancia de 1:1 que nos permite conocer los moles de etileno contenidos en función de la reacción balanceada, también podemos conocer los moles de HCl que son necesario para que se desarrolle la reacción en la relación 1:1, solo bastaría transformar los moles obtenidos en gramos y así conocer los gramos de HCl que se requieren y que podremos hacer reaccionar con los 25 g de etileno presentes.

En este punto, es necesario comprender que a nivel teórico nos basamos en moles de sustancia, sin embargo, a nivel experimental transformamos en gramos ya que es una unidad que nos permite pesar y cuantificar las sustancias, en otras palabras, los coeficientes nos permiten conocer la cantidad de moléculas que participan, mientras que los gramos nos indican la cantidad de masa que se requiere de cada reactivo.
Procesos químicos basados en el rendimiento de las reacciones.
Si analizamos el ejemplo anterior, nos damos cuenta que nuestros cálculos estuvieron basado de manera tacita en los coeficientes de las reacciones balanceadas, sin embargo, en la realidad los procesos químicos se ejecutan en diferentes órdenes que terminan afectando el rendimiento del proceso, a estos comportamientos se les suele denominar como reacciones colaterales, de manera que la cantidad de producto que se forma a nivel experimental resulta ser menor que el esperado de acuerdo a los cálculos estequiometricos.

Partiendo de lo anterior, analicemos el siguiente escenario:
A nivel industrial se utiliza el metil tert-butil éter (MTBE, C5H12O) como aditivo que permite aumentar el octanaje de la gasolina con plomo, la cual ha disminuido su uso ya que produce grandes afecciones a nivel sanitario. Sin embargo, a modo de comprender el proceso químico, debemos conocer que la gasolina se obtiene mediante una serie de reacciones entre isobutileno (C4H8) con metanol (CH4O). Partiendo de ello, ¿Cuál es el rendimiento porcentual de una reacción en la que se utilizan 26,3 g de isobutileno en metanol? A sabiendas que realmente se obtienen 32,8 gramos de MTEB.
En el abordaje teórico del planteamiento propuesto, indiscutiblemente lo primero que debemos hacer es determinar las relaciones estequiometrias en función a las condiciones ideales, de manera que necesitamos calcular la cantidad de metil tert-butil éter, que en teoría se produciría con 26.3 g de isobutileno, este proceso lo podemos detallar en las imágenes a continuación.


Continuando con el abordaje, podemos notar que a nivel teórico obtuvimos un resultado diferente al experimental, lo que nos demuestra que el rendimiento de la reacción es diferente al teórico, lo cual es un indicativo de las reacciones colaterales que se llevan a cabo, disminuyendo así el rendimiento porcentual del proceso ejecutado.

CONSIDERACIONES FINALES

El mundo de la química es amplio, pero conocer el funcionamiento de los diferentes fenómenos que se estudian, nos ha brindado la posibilidad de conocer y entender nuestro entorno, además de aplicar diversos principios que nos permite transformar la materia en materiales de gran utilidad para nuestra sociedad y que han permitidos los avances en las diferentes áreas de nuestra vida, de allí la importancia de profundizar en los aspectos de esta ciencia.

BIBLIOGRAFÍAS CONSULTADAS

[1] McMURRY E., John y Fay C., Robert. (2008). Química general. Quinta edición PEARSON EDUCACIÓN, México, 2009 ISBN: 978-970-26 1286-5.
[2] Ralph, H. Petrucci, William S. Harwood, E. Geoffrey Herring. (2003). QUIMICA GENERAL. Octava edición. PEARSON EDUCACIÓN. S.A., Madrid.

DE INTERÉS

