¡Hola estimados amigos!
En este post centraré el estudio en uno de los factores que pueden afectar el equilibrio químico en una reacción desde el punto de vista cuantitativo, como lo es La Concentración.

Fuente: @yusvelasquez
Recordemos que el Principio de Lechatelier establece que, si una reacción es perturbada, la misma va a reaccionar o a desplazarse en el sentido que contrarreste dicha perturbación para alcanzar nuevamente el equilibrio. Este estado es característico de las reacciones reversibles, es espontáneo, y dinámico.
Su estudio resulta importante ya que conocer las composiciones de las especies que participan en una reacción cuando alcanza el equilibrio proporciona información relevante de cuanto producto se puede formar, y de esta manera estimar el rendimiento, lo cual ejerce gran influencia en los procesos industriales desde el punto de visa económico, para así controlarlo en función a como se ve afectado la posición de equilibrio frente a cambios de temperatura, presión y concentración produciendo cambios en el sentido de la reacción.
Veamos por ejemplo, la siguiente reacción:
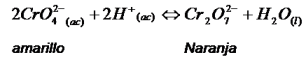
Desde el punto de vista cualitativo podemos observar que ambas especies en la reacción son de distinta coloración, por lo que si se adiciona ácido, se estaría aumentando la concentración de los iones H+, ocasionando que el equilibrio se desplace hacia la derecha predominando asi la especie de color naranja.

Fuente: @yusvelasquez
Ahora bien, desde el punto de vista cuantitativo, cuando se conoce la concentración del reactivo o producto añadido o eliminado, es posible calcular las nuevas concentraciones después de dicha perturbación.
Analicemos el siguiente caso:
Supongamos que se tiene la siguiente reacción en equilibrio:

Cuyas concentraciones son:
[H2] = 0.040 M
[I2] = 0.030 M
Si se adicionan 0.10 moles de HI a un recipiente de 1L.
¿Cuáles son las concentraciones de todas las especies tras alcanzar nuevamente el estado de equilibrio?
Como podemos observar, partimos de un equilibrio, por lo que podemos calcular la constante de equilibrio (Kc) para la reacción dada por la siguiente expresión:
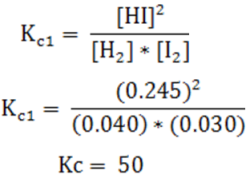
Sin embargo, al adicionar 0.10 moles de I2 se produce una perturbación en el equilibrio alcanzado por la reacción, por lo que las concentraciones se ven afectadas en la siguiente forma:

Con estas nuevas concentraciones podemos calcular el cociente de reacción (Qc) con la siguiente expresión:
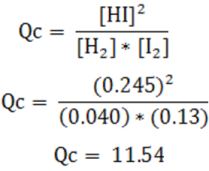
Si comparamos el valor de Qc con Kc, se tiene que:
En este caso, el sentido predominante de la reacción será hacia la derecha, es decir, hacia los productos, con la finalidad de alcanzar nuevamente el estado de equilibrio, y que se igualen ambos valores, por lo que la concentración de los reactivos disminuirá y la del producto aumentará para compensar el cambio.
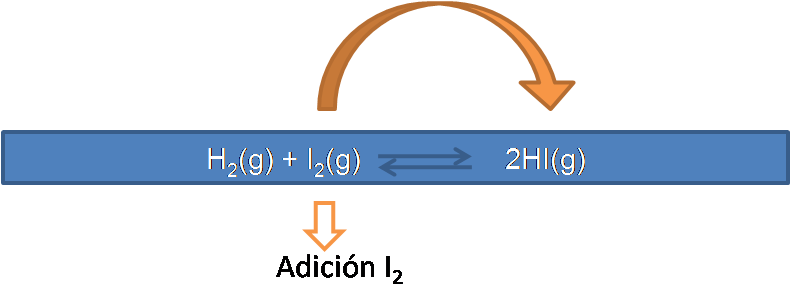
Ahora tenemos las nuevas concentraciones iniciales y podemos calcular las concentraciones en el nuevo equilibrio partiendo del cuadro de equilibrio que viene dado por :

La resolución es la siguiente, partiendo del valor de Kc
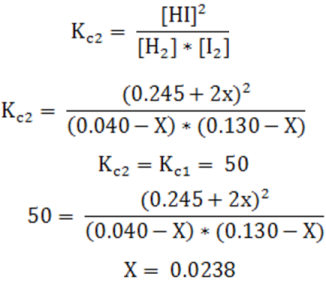
Las concentraciones en el nuevo equilibrio son:
[I2] = 0.1062 M
[HI] = 0.2926 M
En la siguiente figura se muestran los cambios en la reacción

Como se puede observar, parte del I2 que se adicionó se consume por lo que su concentración disminuye al igual que la del H2, y se produce más HI, y se debe cumplir que el Kc1 sea igual a Kc2 a la misma temperatura.
Lo información presentada anteriormente puede servir de guía para el estudio de otros cambios en la concentración, tales como adición de H2 o HI o disminución de cualquiera de los reactivos o productos, solo se debe estar muy atentos en el sentido predominante de la reacción ya que dependiendo de ello dependerán los signos empleados en el cambio en el cuadro de equilibrio.
¡Espero que la información les sea útil, hasta una próxima oportunidad. Gracias por leer!
Referencias
Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editoral Interamericana
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
¡Gracias por el apoyo!
Excelente tema el que has tratado 👌🏻. Mis felicitaciones por el buen manejo que hiciste de la información, a la hora de confeccionar este post
¡Gracias por tu comentario, el equilibrio químico es un tema muy interesante que poco a poco seguiré desarrollando, saludos!
Estaré al pendiente amigo. Mientras te invito a seguirme. Cómo yo te seguiré para tu contenido
Hola @yusvelasquez
es muy interesante el tema que describes y la forma tan didáctica en que lo desarrollaste como tu misma mencionas puede servir de ejemplo para el estudio de problemas de concentración similares a otros.
Hola @sidalim88
El equilibrio químico es un tema fundamental para la comprensión de los equilibrios que ocurren con otras especies por lo que considero importante dominar todos sus fundamentos, ¡gracias por leer y comentar, saludos!