¡Hola estimados amigos de la comunidad científica de Hive!
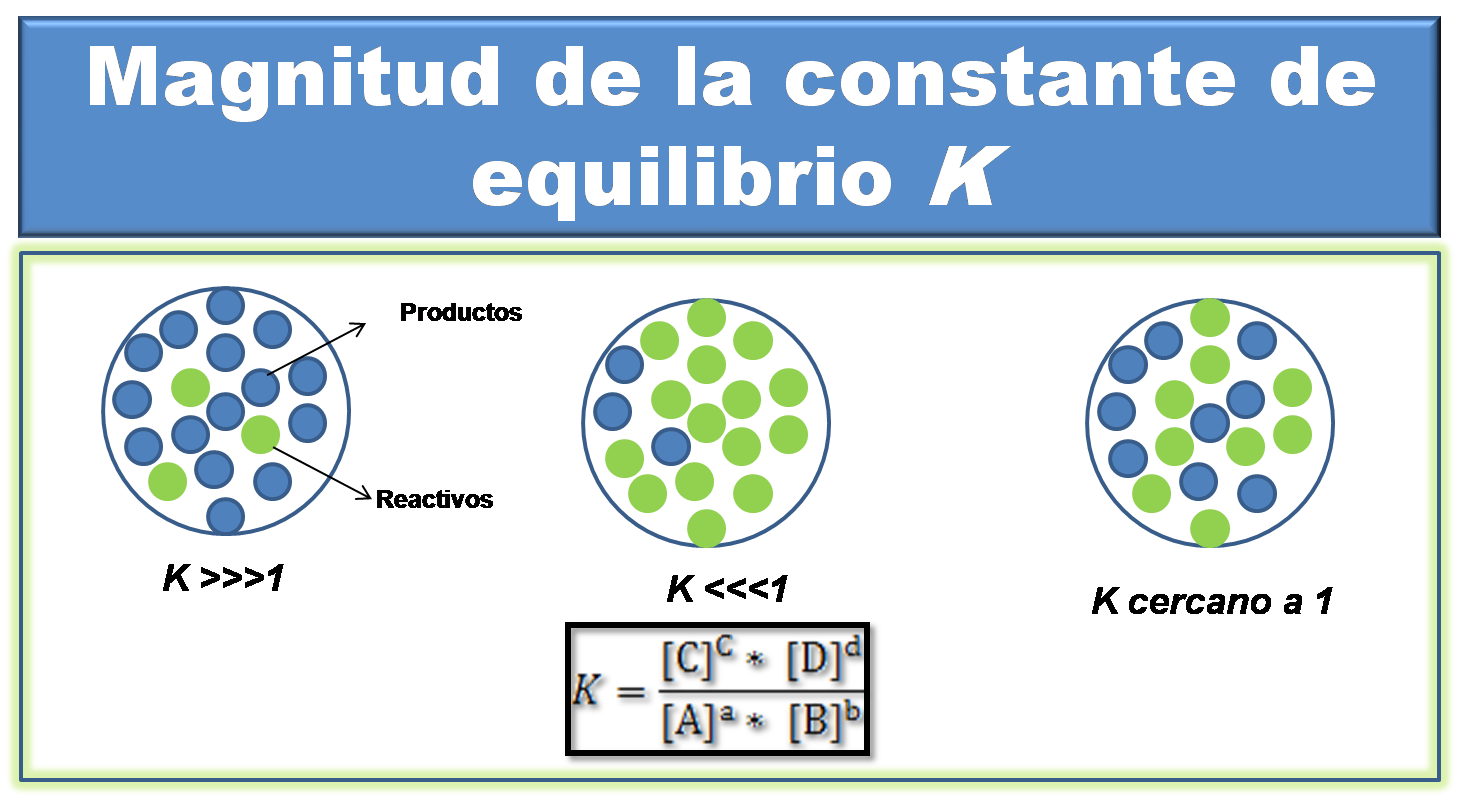
Fuente: @yusvelasquez
Si se parte de la expresión de la constante de equilibrio para una determinada reacción:
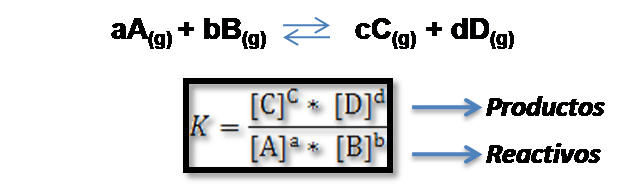
Se puede observar que las concentraciones molares o las presiones de los productos están ubicadas en el numerador y las concentraciones molares o las presiones de los reactivos en el denominador, por lo que el valor de K es directamente proporcional a la concentración o presión de los productos e inversamente proporcional a la concentración o presión de los reactivos. En base a ello, analicemos los siguientes casos.
Cuando el valor de K es muy grandecomparado con 1
En este caso, el valor de la constante indica que los productos están presentes en mayor proporción que los reactivos. Por tanto, en la mezcla en equilibrio prevalecen los productos.
Tal es el caso de la reacción de formación del HCl, para esta reacción el valor de K es de 4*1018 a 500K. Este valor tan elevado, indica que la reacción no alcanzará el equilibrio hasta que la mayor parte de los reactivos se transformen en productos.
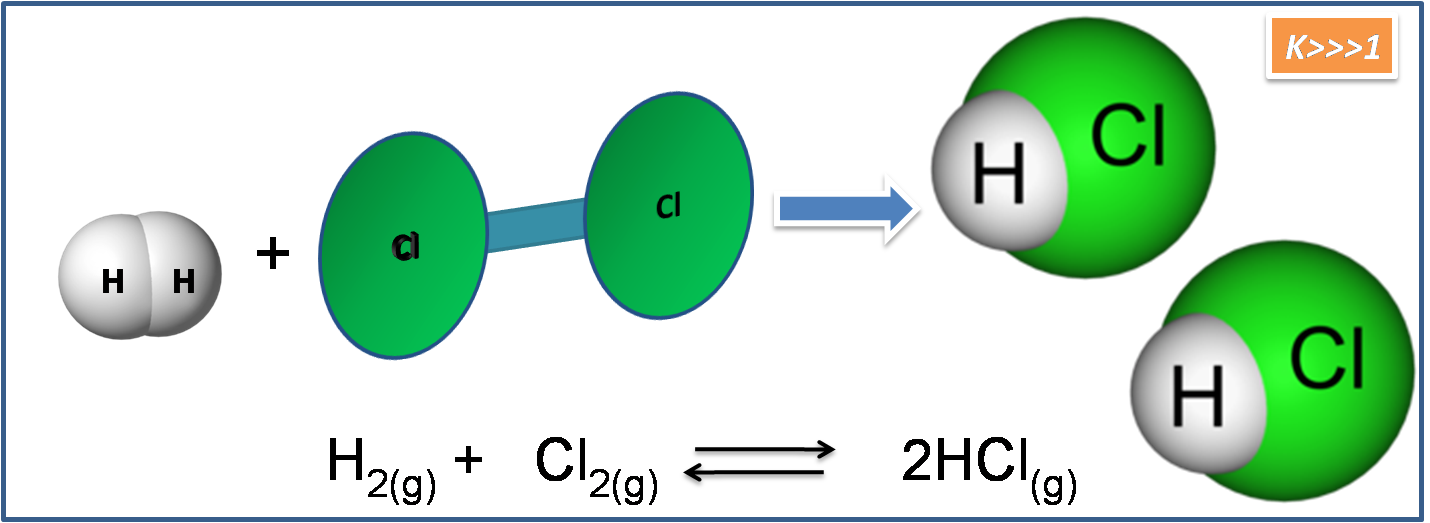
Fuente: Imagen realizada en power point con imágenes de dominio público:1.2
Cuando el valor de K es muy pequeño comparado con 1
Cuando el valor de K es muy pequeño indica que la mayor parte de los reactivos quedaron sin reaccionar, por lo que predomina la reacción inversa.
Un ejemplo de este caso es la reacción de formación del NO. El valor de K para esta reacción es de 3.4*10-21 a 800K.
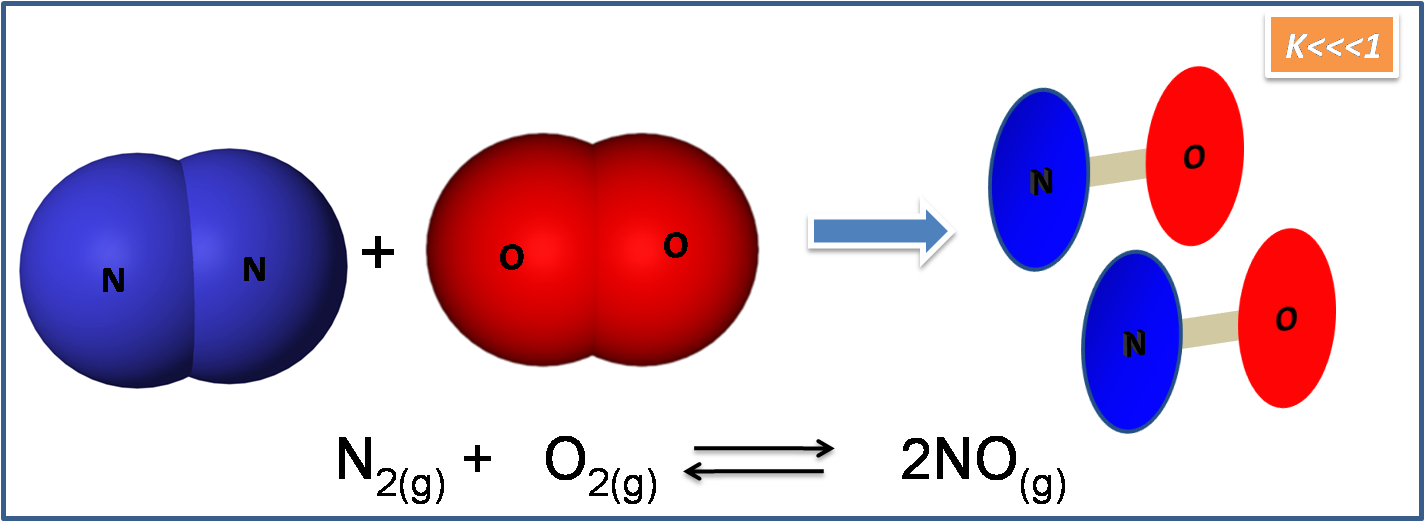
Fuente: Imagen realizada en power point con imágenes de dominio público:1,2
Cuando el valor de K cercano a 1
En este caso la cantidad de producto es similar a la cantidad de reactivos, por lo que en el equilibrio no se ven favorecidos ni los reactivos ni los productos. Para la reacción de formación del SO3 el valor de Kc es de 1.5*10-1.
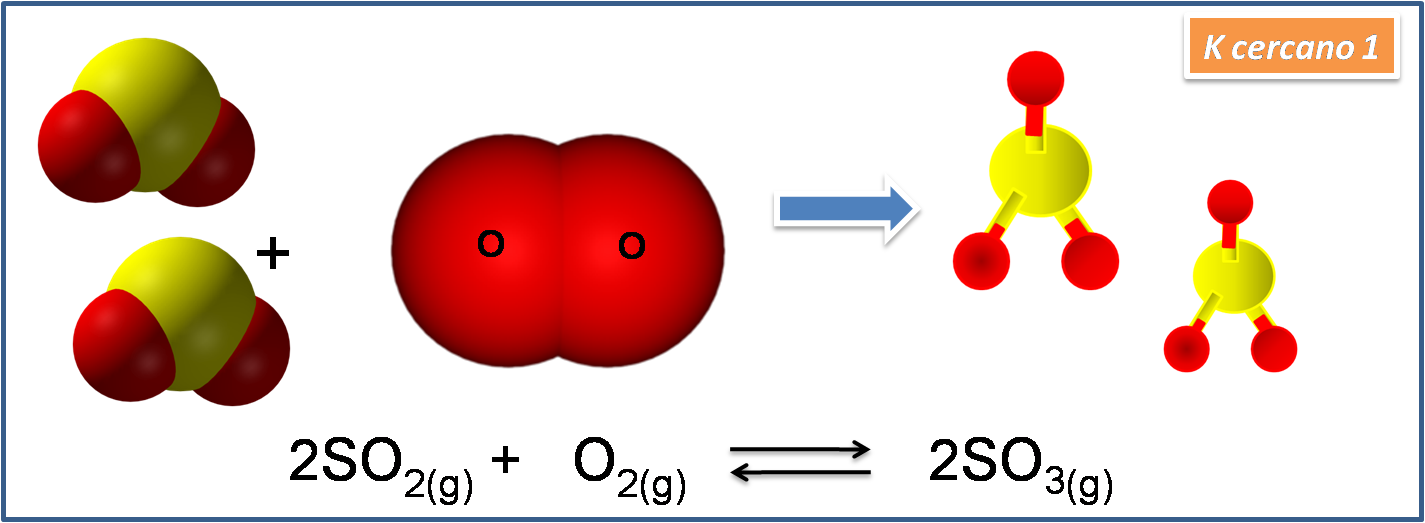
Fuente: Imagen realizada en power point con imágenes de dominio público1,2
De los tres casos estudiados, se puede resumir:
- Cuando el valor de la constante es mucho mayor a 1 el equilibrio favorece a los productos.
- Cuando el valor de la constante está cercano a 1 ni los reactivos ni productos son favorecidos.
- Cuando el valor de la constante es mucho menor a 1 el equilibrio favorece a los reactivos.
Análisis de la magnitud de la constante en el cálculo de las concentraciones.
Tomando en cuenta el valor de la constante se tienen los siguientes casos:
Primer caso: Se tiene la siguiente reacción cuyo valor de Kc es 4.9*10-21 y una concentración inicial de F2 de 0.5M ¿Cuáles serán las concentraciones en el equilibrio?
Para dar respuesta a la incógnita, se completa en primer lugar el cuadro de equilibrio con la reacción correspondiente:
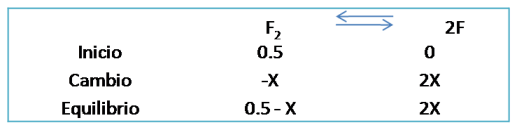
Al expresar la constante para esta reacción se tiene:
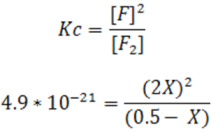
Esta ecuación es de segundo orden y se resuelve por la fórmula cuadrática, sin embargo, se puede simplificar su resolución si se toma en cuenta que el valor de K es muy pequeño, por lo que la desomposición del F2 es muy poca. Si se supone que el valor de X es depreciable en comparación con la concentración inicial de F2 0.5M la ecuación se simplifica como se muestra a continuación:
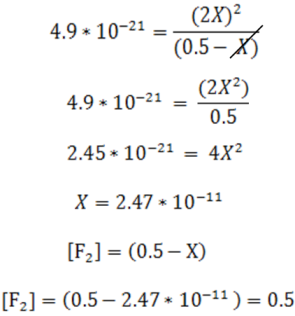
Como se observa al restar 2.47*10-11 el valor de F2 no varía por lo que la suposición realizada es correcta y éste valor puede emplearse para el cálculo de las concentracines en el equilibrio, siendo los resultados los que se muestran a continuación:
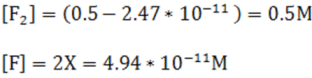
Como se observa en este caso donde K es pequeña el desprecio del valor de X no introduce error ya que la reacción se lleva a cabo en muy poca extensión.
Segundo caso: consideremos el siguiente ejemplo. Para la siguiente reacción el valor de Kc es 4.64*10-3. Si inicialmente se colocan 0.01835 M de N2O4 y se deja que alcance el equilibrio. ¿Cuáles son las concentraciones en el equilibrio de ambos gases?
En este caso se emplea el cuadro de equilibrio de la misma forma que el ejemplo anterior
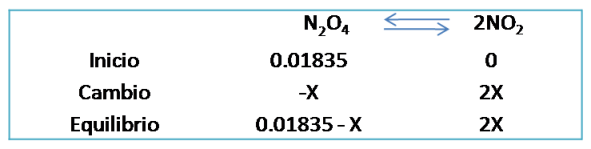
Sustituyendo las concentraciones en la expresión de equilibrio (Kc) se tiene:
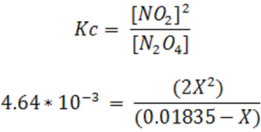
Si para el cálculo se desprecia el valor de X se tiene el siguiente resultado:
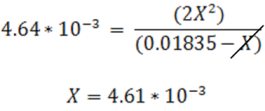
Se debe validar la suposición
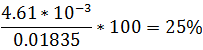
Como se observa X representa el 25% de la concentración inicial. En este caso al despreciar el valor de X se introduce un error considerable, por lo que se puede resolver por la fórmula cuadrática u otra ecuación que resulte de la expresión, esto debido a que al considerarse un valor alto no se puede despreciar la disociación. Se tiene entonces el siguiente resultados:
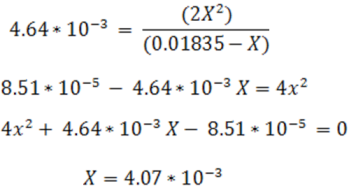
Por tanto, las concentraciones en el equilibrio son:
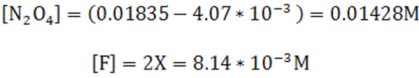
Para la resolución también se puede hacer uso del método de las aproximaciones sucesivas, hasta calcular el valor correcto de X, en especial cuando las ecuaciones son de tercer oreden o de orden superior o problemas más complejos.
En química no solo se debe enfocar la atención en el procedimiento experimental o el resultado cuantitativo, también resulta muy importante analizar el valor numérico, para determinar si se está trabajando bajo las condiciones adecuadas y de esta manera tomar las decisiones correctas en un determinado proceso. En este caso el análisis de la magnitud de la constante permite determinar la dirección predominante en una reacción en equilibrio, lo que permite modificarla para lograr la mayor cantidad de producto posible si ese es el objetivo.
¡Hasta aquí el presente post, espero les sea muy útil la información, gracias por leer!
Referencias
- Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
- Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editorial Interamericana.
- Umland y Bellama (2000). Química General.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
¡Gracias por el apoyo!
Your content has been voted as a part of Encouragement program. Keep up the good work!
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for new Proposal
Delegate HP and earn more
thank you!