ANTIBIÓTICOS BETALACTÁMICOS
Antibiótico: es una sustancia formada por el metabolismo de organismos, en un principio empezaron siendo hongos, tienen la capacidad de inhibir el crecimiento o destruir otros microorganismos.
Dentro de los antibióticos encontramos una variedad amplia de ejemplares, estos se clasifican dependiendo de sus composiciones químicas por lo que se diferencias en varios grupos, entre los que podemos mencionar están: betalactámicos, glucopéptidos, aminoglucósidos, lincosamidas, sulfamidas, quinolonas entre otros grupos; en este caso en particular hablaremos sobre los betalactámicos, clasificación, mecanismo de acción e indicaciones de los mismos.

Imagen sin derechos de autor. Obtenida de Pixnio Autor: Bicanski
Los betalactámicos actúan inhibiendo la síntesis de la pared bacteriana, es decir que, mediante ciertos procesos, evitan la formación de la pared que le da estructura y protege a la bacteria por lo que esta se hace débil y por diferencias de presiones esta estalla.
Para comprender la forma en que actúan estos fármacos, debemos conocer primero la síntesis de la pared bacteriana. La pared es una estructura vital para las bacterias, es la división del exterior y el interior de la célula.
SÍNTESIS DE LA PARED BACTERIANA
La base de la pared está conformada por el peptidoglicano Mureína el cual está conformado por una secuencia de N-acetil-glucosamina (NAG) y el ácido N-acetilmurámico (NAM) unidos por en laces ß-1,4. Para producir la síntesis de la pared se deben realizar 4 etapas:
- Síntesis de precursores
- Transporte a través de la membrana
- Transglucidación
- Transpeptidación
Síntesis de los precursores: Los monosacáridos (NAM y NAG) se activan al unirse a uridín-difosfato (UDP). Entonces se sintetizan por separado: NAG-UDP Y NAM-UDP. Posteriormente se irán añadiendo de manera secuencial y ordenada de los distintos aminoácidos al NAM (estas reacciones requieren energía e iones Mn++): L-ala, D-glu, m-DAP (u otro diaminoácido), D-ala-D-ala.
Se obtiene finalmente un pentapéptido. El último paso es la adición del dipéptido D-alanil-D-alanina, que se ha sintetizado en dos fases. Primero la catalización de los sustratos por la enzima Alanina Racemasa (Pasa de la L-alanina a la D-alanina) Y luego la unión de dos compuestos (D-alanina + D-alanina) a través de la Alanina Sintetasa.
Transporte a través de la membrana: El UDP-NAM-pentapéptido se transfiere ahora a un transportador de membrana, llamado undecaprenil-fosfato en una reacción catalizada por una enzima (translocasa) específica.
Al undecaprenil-fosfato se le conoce también con el nombre de bactoprenol, pero hoy se sabe que este no es exclusivo de bacterias. El bactoprenol permite el transporte y ensamblaje de sustancias hidrofílicas.
Una vez que el NAM-pentapétido está unido al bactropenol (a través de pirofosfato), una transferasa transfiere, valga la redundancia, a éste la NAG desde el UDP-NAG. Se forma el enlace ß-1,4 entre NAG y NAM. Tanto la translocasa como la transferasa está localizadas en el lado citoplásmico de la membrana, de modo que el precursor que hemos obtenido, está de cierta manera libre, como una cuerda colgante hacia el citoplasma y fijado a la lámina interna de la membrana a través del undecaprenil-fosfato.
Transglucosidación: Ahora el undecaprenil-fosfato hace lo que se conoce como flip-flop (digamos que se da la vuelta desde la capa interna hacia la externa), entonces se produce una reacción de transglucosidación. Radica en la unión de cada unidad, el disacárido (con su pentapéptido) con el extremo libre de una cadena preexistente. En este paso se libera el undecaprenil, pero en forma pirofosforilada de manera que actúa una fosfatasa específica que descarta el fosfato terminal y se vuelve a formar el undecaprenil-fosfato listo para otro ciclo.
Transpeptidación: lo obtenido de la fase anterior es una cadena lineal de peptidoglicano sin entrecruzar, y unido aún al bactropenol. Este polímero naciente reacciona, por transpeptidación, con un peptidoglicano receptor preexistente. La energía utilizada en esta reacción es suministrada por la hidrólisis análoga del enlace peptídico entre las dos D-ala terminales. La enzima que cataliza la formación de estos enlaces son las PBP (penicillin binding proteins), es decir que la relación entre las PBP y la síntesis de la pared celular es que las PBP están en la parte externa de la membrana citoplasmática y a medida que va saliendo el peptidoglicano que se está uniendo al núcleo de crecimiento estas enzimas van a unir una y otra vez, sin parar mientras haya crecimiento y multiplicación bacteriana.
Los betalactámicos se unen de forma covalente a las PBP que tienen acción de transpeptidasa, carboxipeptidasa; cuando se unen a las PBP inhiben la acción del peptidoglicano, inhiben la formación de enlaces, hay activación de las autolisinas por pérdida del inhibidor y si hay activación de esas autolisinas va haber destrucción, ayudando a ese efecto lítico de los β-lactámicos.
La afinidad de los betalactámicos sobre estas PBP es lo que nos da su mecanismo de acción, ya que inhiben las acciones de estas PBP para la formación de enlaces y, en resumen, la síntesis de la pared bacteriana.
¿Es importante desde el punto de vista médico conocer este mecanismo de acción? Sí. Ya que muchas bacterias han generado mecanismos de defensa contra estos fármacos. Además que también hay distintos antibióticos, que a pesar que son de la misma familia; como ejemplo se puede mostrar los Carbapenémicos que son betalactámicos, ambos actúan sobre la fase de transpeptidación de las membranas, sin embargo, la afinidad de ellos es distinta, el Imipenem posee afinidad sobre las PBP-2 en un 99%, en cambio, Meropenem posee afinidad en las PBP-3 y en menor porcentaje en las PBP-2 y a pesar de que en un antibiograma, pueda resultar RESISTENTE a Imipenem, conociendo esto, no podemos excluir el uso del Meropenem y se debe intentar administrar tratamiento con este.
CLASIFICACIÓN DE ANTIBIÓTICOS BETALACTÁMICOS
De manera académica podemos dividir los betalactámicos de esta manera:
- Penicilinas: Penicilinas naturales, Aminopenicilinas, Penicilinas resistentes a penicilinasas, Carboxipenicilinas, Ureidopenicilinas.
- Cefalosporinas
- Monobactámicos
- Carbapenémicos
Penicilinas
- Penicilinas naturales: son los primeros introducidos en el aspecto médico, tienen una utilidad actualmente reducida, debido a que las bacterias han desarrollado muchos mecanismos de defensa por tantos años de uso de los mismo.
Penicilina G Cristalina o Bencilpenicilina: Es activo contra muchas bacterias, pero fue desplazada por otros antibióticos para infecciones por gérmenes que desarrollaron resistencia. Es activa especialmente contra: Cocos gram positivos. Es muy activa contra Streptococcus betahemolítico grupo A, pero menos activas contra Streptococcus grupo B (S. agalactiae). Cocos gram negativos: De elección para tratar las infecciones por Neisseria meningitidis, incluyendo la meningitis. Bacilos gram positivos tales como: Corynebacterium diphteriae (ojo, sólo esta especie en particular), Listeria monocitogenes, Bacillus antrhacis. Treponema pallidum, Leptospira spp. Anaerobios: Clostridium tetani, C. perfringens. Fusobacterium spp., Peptostreptococcus spp., Actinomyces israelli.
.png)
Estructura química de la Penicilina G.
Imagen sin derechos de autor. Obtenida de Wikimedia Commons Autor: Cacycle
Es útil para iniciar un tratamiento empírico de: Neumonías adquiridas en la comunidad en paciente joven sin comorbilidad con cuadros de neumonías típicas. Infecciones de piel y partes blandas cuando se sospecha que son de origen estreptocóccico. Faringitis de supuesta etiología bacteriana.
Otros exponentes: Penicilina G procaína y Penicilina G benzatínica de apliación IM
- Aminopenicilinas: Son penicilinas, pero con un espectro superior a las anteriores, sus representantes son la ampicilina y amoxicilina. El espectro donde actúan es parecido a la penicilina G contra gérmenes grampositivos y gramnegativos, pero se añaden bacilos gramnegativos como E. coli, H. influenzae, Proteus mirabilis, Salmonella spp. y Shigella spp.
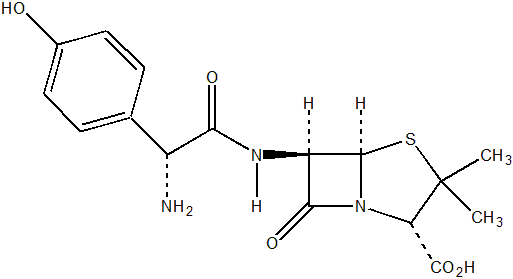
Estructura química de la Amoxicilina.
Licencia: CC BY-SA 3.0 Imagen obtenida de Wikimedia Commons Autor: Cmx
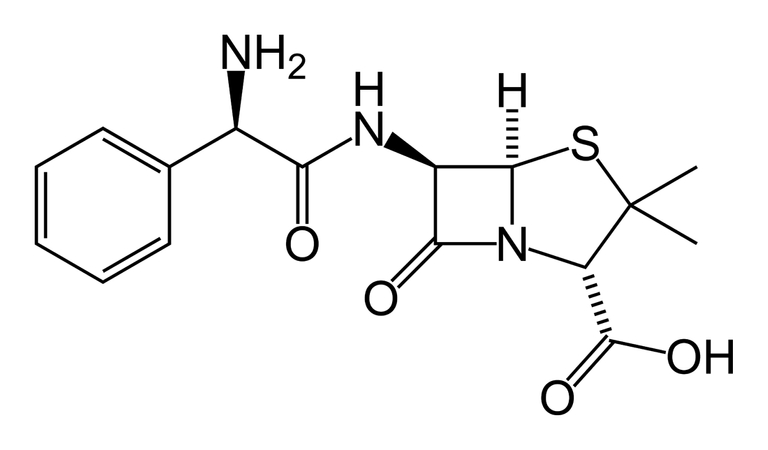
Estructura química de la Ampicilina
Imagen sin derechos de autor. Obtenida de Wikimedia Commons Autor Benjah-bmm27
- Penicilinas resistentes a penicilinasas: Estos antibióticos tienen menor potencia que la penicilina G, se estima que entre 10% a 20% pero son estables frente a las penicinilasas estafilocóccicas. Esto es suficiente para eliminar estreptococos, estafilococos, meningococos y gonococos, pero no son activas contra enterococos ni bacterias gram negativas. Tenemos como exponentes a la Oxacilina, Cloxacilina, Dicloxacilina.
- Carboxipenicilinas: Son penicilinas de espectro amplio. Son antibióticos contra Pseudomonas aeruginosa. La Carbenicilina fue la primera sintetizada y reemplazada actualemente por la Ticarcilina que es más activa, menor resistencia y efectos indeseados.
Indicadas frente a Pseudomonas, Enterobacter, Morganella, Proteus. Si mencionamos su acción, es comparable a la ampicilina sobre E.coli, Salmonella, Shigella, N. meningitidis y P. mirabilis
Penetran bien en los tejidos, pero no están indicadas cuando se aísla Pseudomonas en líquido cefalorraquídeo (LCR).
- Ureidopenicilinas: La Piperacilina resalta en esta sección, su espectro es amplio y activa contra Pseudomonas aeruginosa. Sólo se administra por vía IV ya que no se absorbe por vía oral. Penetra de manera excelente en los tejidos y estas son las indicadas ante infección aislada de Pseudomonas en líquido cefalorraquídeo (LCR). Un 20 a 30% se elimina por el hígado por lo que se alcanza una buena concentración en el tracto biliar.
Tienen amplio espectro contra bacterias grampositivas y gramnegativas, incluyendo anaerobias; pero su actividad es reducida comparada con las aminopenicilinas contra especies de Enterococcus y Streptococcus.
Cefalosporinas
Gran número de antibióticos que reúnen peculiaridades que los hacen especiales: amplio espectro, fácil administración y muy poca toxicidad. Son considerados agentes de primera línea en situaciones clínicas variadas: neumonías nosocomiales y adquiridas en la comunidad, infecciones de piel y partes blandas, infecciones urinarias, en meningitis las de tercera generación son la primera opción, sepsis e infecciones relacionadas a los cuidados de salud. Las de primera generación son usadas en las profilaxis pre operatorias y de entrada en muchos servicios hospitalarios, destacando la Cefazolina, Cefalotina. En infecciones abdomino-pélvicas, la combinación de cefalosporinas de tercera generación con metronidazol da excelentes resultados.
Si hablamos de su química, están formadas por el ácido 7-aminocefalosporánico formado por un anillo betalactámico unido a un anillo dihidrotiazida. La capacidad de modificar ciertas estructuras permite la gran variedad de cefalosporinas, dándoles variedades terapéuticas.
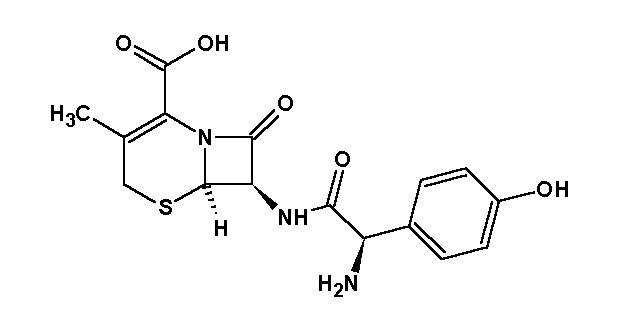
Estructura química del Cefadroxil, cefalosporina de primera generación
Imagen sin derechos de autor. Obtenida de Wikimedia Commons Autor Margoz

Estructura química de la Ceftriaxona, cefalosporina de tercera generación.
Imagen sin derechos de autor. Obtenida de Wikimedia Commons Autor: Edar181
Su vía de administración depende de la cefalosporina que se hable, sin embargo, se cuentan con administración oral y parenteral para casi todas las generaciones. Penetran bien en los tejidos y fluidos corporales, las de primera generación no alcanzan niveles óptimos en líquido cefalorraquídeo (LCR), este apartado lo lideran las cefalosporinas de tercera generación. Tienen en su mayoría una vida media corta por lo que su administración debe hacerse cada 6 u 8 horas. De todas, Ceftriaxona es la que más vida media tiene y por lo general se indica una vez al día.
Monobactámicos
Son antibióticos vinculados estrechamente con los betalactámicos, pero exhiben una disposición monocíclica. El de importancia en medicina es Aztreonam, destacando que fue un fármaco sintetizado. Este fármaco es activo contra cepas resistentes de bacilos gramnegativos vinculados a centros de salud.
Se debe administrar por vía IV ya que sólo se absorbe un 1% por vía oral. Se distribuye en todos los tejidos y líquidos corporales de una manera amplia, alcanza niveles terapéuticos en líquido cefalorraquídeo (LCR) pero es una de las últimas opciones en estas infecciones después de cefalosporinas de tercera generación, carbapenémicos, Rifampicina y Cloranfenicol.
Entre sus indicaciones son parecidos a los aminoglucósidos y en la mayoría de los casos, se indican en terapia combinada. Al incluir otros agentes antimicrobianos, resulta muy útil para el tratamiento empírico de infecciones intrabdominales (Aztreonam + Clindamicina o Vancomicina). Es útil en tratamiento de pacientes oncológicos, neumonías vinculadas a los cuidados de salud (Aztreonam + Clindamicina). Entre sus contras, se describen alergia directa al medicamento.
Carbapenémicos
Hay muchos nuevos fármacos sintetizados bajo diversos estudios y ensayos, sin embargo, los que marcan tendencia en este grupo son Imipenem y el Meropenem, excelentes inhibidores de las betalactamasas. Sin embargo, el Imipenem es degradado por la dehidropeptidasa del riñón, por lo que se implemente con la unión de un inhibidor de esta enzima como es la cilastatina, de esta manera aumenta su vida media considerablemente.
Los carbapenémicos tienen alta efectividad hacia los microorganismos causantes de meningitis. El Imipenem y el Meropenem ingresan de modo excelente el líquido cefalorraquídeo (LCR) con meninges inflamadas. El Meropenem es similar a la Cefotaxima (cefalosporina de tercera generación) en el tratamiento de infecciones del sistema nervioso central, tiene la ventaja que no provocan convulsiones como han sido descritas con Imipenem y es efectivo en la meningitis por P. aeruginosa multirresistentes. En líneas generales son usados en tratamientos donde otras opciones terapéuticas han fallado, por su versatilidad y muy amplio espectro antimicrobiano.

Referencias Bibliográficas:
- Goodman & Gilman: Las bases farmacológicas de la terapéutica, 12e.
- Biología Celular Biomédica. Alfonso Calvo.
- Introducción a la Biología Celular. Alberts-Bray-Hopkin-Johnson-Lewis-Raff-Roberts-Walter. 2e.
- Terapéutica de las enfermedades Infecciosas en Pediatría y Adultos. Dr José H Pabón.
- Clases y apuntes.
¡GRACIAS POR LEER MI POST! ¡NOS VEMOS!

Felicitaciones por tu post. Está bastante completo. Hay que tener buena memoria para memorizar todos esos términos 😄
Muchas gracias. Y sí, hay cosas que he tenido que volver a leer para explicarlas bien. Pero es cuestión de repasar cada cierto tiempo. Saludos!
Un artículo trabajado.
Upvoted.
Te he mencionado aqui: Posts Votados y sugeridos 28/Mayo
Muchas gracias hermano! Estaré pasando por ese post. Saludos! Estos comentarios incentivan!
Congratulations! This post has been upvoted from the communal account, @minnowsupport, by abelgdo from the Minnow Support Project. It's a witness project run by aggroed, ausbitbank, teamsteem, theprophet0, someguy123, neoxian, followbtcnews, and netuoso. The goal is to help Steemit grow by supporting Minnows. Please find us at the Peace, Abundance, and Liberty Network (PALnet) Discord Channel. It's a completely public and open space to all members of the Steemit community who voluntarily choose to be there.
If you would like to delegate to the Minnow Support Project you can do so by clicking on the following links: 50SP, 100SP, 250SP, 500SP, 1000SP, 5000SP.
Be sure to leave at least 50SP undelegated on your account.