Saludos estimados amigos de steemit, especialmente la comunidad científica de #STEM-Espanol.
Una valoración es una técnica mediante la cual, agregamos paulatinamente una solución de concentración exactamente conocida denominada solución patrón, a otra de concentración desconocida. Si conocemos el volumen inicial de solución desconocida, es fácil determinar la concentración de esta solución al establecer el volumen necesario de solución patrón para completar la reacción entre ambas[1].

Estandarización de soluciones. Fuente: @emiliomoron
Sin embargo, aun cuando hemos realizado muy bien el cálculo de las cantidades de soluto y solvente necesarias para preparar una solución a una concentración determinada, la propia preparación puede llevar consigo errores por nuestra parte, como aproximaciones en la pesada o errores de apreciación de los instrumentos, que pueden hacer variar el resultado experimental de los cálculos realizados. Por otro lado, existen soluciones cuya estabilidad se ve afectada por el tiempo o la exposición a agentes atmosféricos, por ejemplo, una de las soluciones que más utilizamos para realizar valoraciones es el hidróxido de sodio, y este compuesto puede absorber agua cuando se encuentra de forma sólida y en solución puede reaccionar con el dióxido de carbono; de modo que, si ha estado algún tiempo almacenada, cuando requerimos utilizarla quizás su concentración ha cambiado con respecto al momento de su preparación.
Y bueno, cuando vamos a realizar algún análisis químico cuantitativo preciso, es sumamente importante poder conocer con precisión la concentración de las soluciones con las cuales nos disponemos a trabajar, puesto que, incluso ligeras variaciones respecto al valor teórico calculado, nos puede conducir a resultados erróneos o tener un efecto diferente al esperado. Por lo tanto, en los laboratorios de química, un procedimiento indispensable es la estandarización de las soluciones frente a un patrón primario.
Entonces, ¿Qué es una estandarización?
Cuando en química hablamos de una estandarización, hacemos referencia a un proceso mediante el cual se determina de forma exacta la concentración de una solución valorante mediante su reacción con una solución denominada patrón primario. Este patrón primario es una disolución de una sustancia que por su notable estabilidad puede ser empleada para determinar la concentración de otras soluciones.
La estandarización de una solución se realiza mediante una valoración volumétrica, utilizando la técnica de la titulación, pudiendo ser la clásica titulación colorimétrica o instrumental como la potenciométrica.

Clasica valoración volumétrica de una solución básica. Fuente: @emiliomoron.
Dicho de otro modo, la estandarización no es más que la obtención de una solución estándar secundaria, la cual será empleada en un determinado análisis cuantitativo como solución patrón o de referencia.
Por ejemplo, el hidróxido de sodio se utiliza como solución valorante para determinar la acidez de una muestra problema, por lo que el resultado depende directamente de la concentración de hidróxido de sodio empleada. Para poder establecer la concentración de la solución de hidróxido de sodio se debe titular esta con una solución ácida de concentración establecida con suma precisión, para ello el ácido que se utiliza con frecuencia es el ftalato ácido de potasio (KHC8H4O4) como patrón primario. El ftalato ácido de potasio es un sólido muy estable que se puede conseguir comercialmente de forma muy pura. La reacción de este ácido con el hidróxido de sodio procede según la reacción:
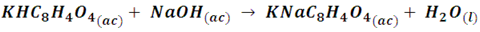
¿Y cómo realizamos una estandarización?
Tomemos como ejemplo la estandarización de una solución de NaOH.
Para la estandarización de esta solución, se procede a su valoración con una solución de ftalato ácido de potasio. Para ello pesaremos una cantidad aproximada de 0,5 g de ftalato ácido de potasio y lo introduciremos en un erlenmeyer donde lo disolveremos agregando 25 mL de agua destilada, a esta solución le agregaremos dos gotas de fenolftaleína para que actúe como indicador.
Se enraza una bureta de 25 mL con la solución de hidróxido de sodio para comenzar la valoración, procediendo a verter gota a gota esta sobre la solución patrón contenida en el erlenmeyer mientras se agita constante, hasta alcanzar una coloración rosa en la solución del patrón primario. En este momento se cierra la válvula de la bureta y se anota el volumen gastado, el cual corresponde al volumen experimental.

Titulación de la solución del patrón primario (erlenmeyer) con NaOH (solución en la bureta). A la izquierda antes de la valoración y a la derecha una vez alcanzado el punto final. Fuente: @emiliomoron.
Con este volumen y el volumen teórico se obtiene el factor de corrección para la concentración de la solución.

Donde, KHP corresponde al ftalato ácido de potasio, PE es el peso equivalente (que para el ftalato ácido de potasio es igual a su masa molar). Entonces,


Es importante recordar que debemos realizar el procedimiento por triplicado para asegurar la reproducibilidad de los resultados.
¿Qué características debe poseer un patrón primario?
Las sustancias que se utilizan como patrón primario deben cumplir con una serie de características a fin de poder cumplir con esta función, estas se pueden encontrar establecidas en la literatura[2,3], pero podemos mencionar entre las más resaltantes:
Tener elevada pureza: las impurezas pueden constituir interferencias durante un análisis, sobre todo cuando realizamos análisis cuantitativos, por lo que un patrón primario debe carecer de impurezas, al menos no exceder de 1%, y que estas no reaccionen con él o la sustancia a valorar.
Poseer estabilidad a condiciones ambientales: por lo antes mencionado, un patrón primario debe ser una sustancia cuya composición no cambie por su exposición a los factores ambientales como humedad o exposición a la luz, o absorber gases durante su contacto con el aire. Ya que tales condiciones afectarían la integridad del patrón y por lo tanto introducir errores por cambios en su composición.
Estabilidad a temperaturas de secado: es posible que se requiera de su secado en estufa antes de preparar una solución, por lo que debe ser estable incluso a temperaturas mayores a 100 ºC para garantizar su secado.
Producir reacciones rápidas y directas con el compuesto a valorar. Es indispensable para realizar un cálculo preciso, que la reacción entre el patrón primario y el compuesto valorado no conduzca a reacciones paralelas o cuya estequiometria resulte difícil de establecer, además de que la reacción se produzca de forma rápida y apreciable para evitar errores durante la titulación.
Consideraciones finales
Cuando se realizan análisis químicos cuantitativos se requiere de una gran exactitud de las soluciones a emplear, a fin de garantizar resultados precisos, por lo que la estandarización de las soluciones es una técnica básica necesaria para cualquier investigador.
Elegir un patrón primario dependerá del tipo de solución a estandarizar, así como el ftalato ácido de potasio se puede emplear para valorar el hidróxido de sodio sirve para otras soluciones básicas. Pero si se trata de soluciones acidas el carbonato de sodio suele ser el patrón más empleado; y si se tienen compuestos de naturaleza oxidante, reductora o que forman complejos, será necesario elegir un patrón primario apropiado.
Conocer la ecuación química balanceada que describe la reacción entre el patrón primario y el compuesto a valorar es sumamente importante para poder realizar un cálculo preciso de la concentración.
Se debe realizar la estandarización de una solución así se haya recién preparado o tenga tiempo almacenada, puesto que la forma de preparación y el paso del tiempo pueden influir en el valor real de su concentración, y con ello afectar el análisis realizado.
Referencias
- Chang, R. (2002). Química. Séptima edición. Editorial MacGraw-Hill.
- Clavijo, A. (2002). Fundamentos de química analítica: equilibrio iónico y análisis químico. Univ. Nacional de Colombia.
- Wikipedia.com. Solución estándar

Si desean consultar otros artículos de calidad en áreas de Ciencia, Tecnología, Ingeniería y Matemáticas (STEM, por sus siglas en inglés) en nuestro idioma español pueden hacerlo visitando la etiqueta #stem-espanol, también puedes realizar tus aportes, para ello revisa los criterios de curación y además la normativa para el uso de imágenes en la siguiente publicación: https://steemit.com/stem-espanol/@stem-espanol/presentacion-stem-espanol.

¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias por el apoyo equipo de entropía!
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Thank you very much for the support my friends!
Saludos @emiliomoron, bastante interesante y útil este post. Estoy seguro que es una de las practicas iniciales de los laboratorios de fisicoquímica y por su puesto de uso cotidiano en laboratorios de química analítica que utilicen métodos clásicos para el análisis. Creo que el ftalato ácido de potasio y el tiosulfato de sodio son patrones primarios bastante comunes, precisamente por cumplir las características que en el post enumeras. Estoy seguro que consultare este post cuando vaya a realizar una valoración de este tipo, gracias por compartir, saludos!
Saludos estimado @aleestra. Muchas gracias por tu apreciación, ciertamente es una práctica esencial en los laboratorios, especialmente en el de analítica, y si, esos son bastante comunes precisamente por reunir esas características, me alegra que el post te pueda servir para consultar, ese es el principal propósito de compartir la información. Gracias por pasar a leer y dejar tu comentario!
Hi @emiliomoron!
Your post was upvoted by Utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Thank you very much!
Buenos días amigo, excelente post, muy interesante y muy bien explicado, desde hoy te sigo...
Saludos amigo @millergil21. Muchas gracias por tu apreciación y por seguir mi blog, también pasare a ver tu contenido.
Saludos @emiliomoron te felicito por tan importante aporte. Dentro de los (04) grupos de Valoraciones que se conocen en química (Redox, Complejométricas o Formación de Complejos y Precipitación), la valoración Ácido-Base es la que se usa comúnmente en la industria. El NaOH se usa para determinar el acidez de la leche mediante titulación o para producir jabón mediante una reacción de saponificación con una grasa vegetal o animal. Las conclusiones que se obtienen de estos análisis, podrían conducir a errores o a una mala interpretación, sino se toma la previsión de valorar adecuadamente el NaOH con un patrón primario como el ftalato ácido de potasio, las razones de este hecho están claramente explicadas en el Post. Gracias por compartir esta información!! Saludos.
Saludos estimado @wilmer14molina. Muchas gracias por tus felicitaciones y por dejar un comentario que viene a complementar el post, ciertamente por exceso de confianza se podrían dejar de realizar esta operación con lo que se conducirían a obtener errores como bien comentas, y siendo esta técnica tan importante es mejor proceder adecuadamente. Gracias por pasar a leer!
Congratulations @emiliomoron! You received a personal award!
Click here to view your Board
Congratulations @emiliomoron! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board
If you no longer want to receive notifications, reply to this comment with the word
STOP