Saludos comunidad de Hive. Particulares saludos para todos mis Steemians-Lectores. En esta oportunidad les comparto la segunda parte de mi post titulado CONCEPTOS FUNDAMENTADES DE LA TERMODINAMICA - PARTE 1. Como lo expresé en el anterior post, considero que conociendo este material es posible abordar posteriormente, con mucha mayor facilidad y claridad, contenidos específicos de Termodinámica.
Al hacer click en el siguiente enlace, serás dirigido al contenido de mi post: CONCEPTOS FUNDAMENTADES DE LA TERMODINAMICA - PARTE 1

Al inicio de la parte 1 de este post, amigos lectores, les hablé de los dos métodos utilizados para el estudio de los sistemas termodinámicos: el Método Estadístico y el Método Termodinámico. Recordemos que el primero se basa en la utilización de la teoría de probabilidades y de determinados modelos de estructura de los sistemas que se estudian. Por otro lado, el segundo no toma en cuenta la estructura interna de los sistemas (sustancias de los cuerpos) que se estudian ni el carácter del movimiento de las partículas aisladas, sino que se basa en el estudio de las distintas transformaciones de la energía que se producen en el sistema. En la figura 1 les muestro una representación de ambos puntos de vista para un sistema formado por un contenedor de gas.
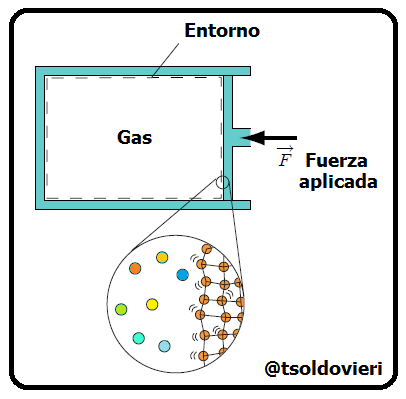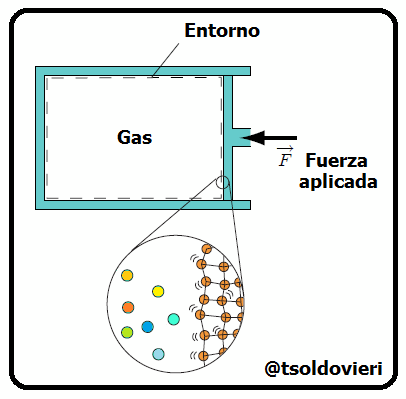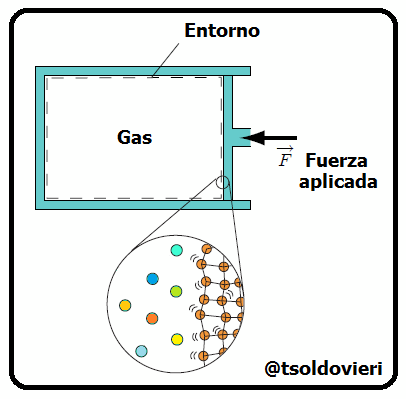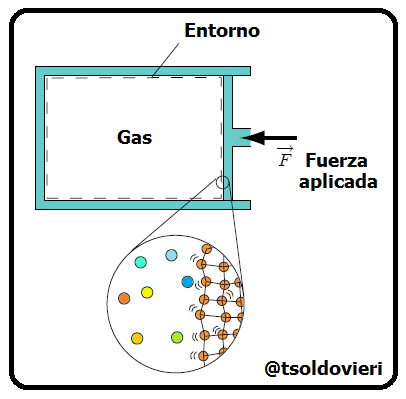
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Ahora bien, mis muy atentos lectores, de los 2 métodos utilizados para estudiar las propiedades de los sistemas, seguiremos de aquí en delante con el segundo que, como mencioné en la parte 1, es el usado en la parte de la Física denominada Termodinámica.
La Termodinámica se ocupa de la energía y sus transformaciones en los sistemas, desde un punto de vista macroscópico. Sus leyes son restricciones generales que la naturaleza impone en todas esas transformaciones |
|---|
Estimados amigos lectores, la Termodinámica se basa sobre dos leyes fundamentales establecidas gracias a la generalización de un conjunto de hechos experimentales (la primera y segunda Ley de la Termodinámica) y en el Teorema del Calor de Walther Nernst (vean la figura 2) que algunos señalan como Tercera Ley de la Termodinámica. Por esta causa, las conclusiones de la Termodinámica tienen un carácter muy general.

De Unknown (Mondadori Publishers) - http://www.gettyimages.co.uk/detail/news-photo/portrait-of-the-german-chemist-and-physicist-walter-hermann-news-photo/141553142, Dominio público - Fuente
Es una teoría de una gran generalidad, aplicable a sistemas de estructura muy elaborada con todas las formas de propiedades mecánicas, eléctricas y térmicas complejas. Puesto que la Termodinámica se focaliza en las propiedades térmicas, es conveniente idealizar y simplificar las propiedades mecánicas y eléctricas de los sistemas que serán estudiados. En el presente estudio de la Termodinámica se idealizarán los sistemas para que sus propiedades mecánicas y eléctricas sean lo más triviales posibles. Cuando el contenido esencial de la Termodinámica haya sido desarrollado, será una cuestión simple extender el análisis a sistemas con estructuras mecánicas y eléctricas relativamente complejas. La cuestión esencial es señalar que las restricciones en los tipos de sistemas considerados no son limitaciones básicas sobre la generalidad de la Teoría Termodinámica y sólo se adoptan meramente para la simplificación expositiva. Se registrará, a menos que se indique lo contrario, la atención a sistemas simples, definidos como sistemas que son macroscópicamente homogéneos, isótropos y desprovistos de carga eléctrica, que son lo suficientemente grandes para que los efectos de frontera puedan ser ignorados y que no se encuentran bajo la acción de campos eléctricos, magnéticos o gravitacionales.
5 - ESTADO TERMODINAMICO:
Un Estado Termodinámico es la condición en la que se encuentra un sistema, la cual es definida por un conjunto de los parámetros macroscópicos individuales que toman las propiedades de un sistema que deben ser especificadas para reproducir el mismo. |
|---|
Lectores, el estado de un sistema termodinámico queda definido cuando cada uno de sus parámetros individuales tiene un valor determinado. Si éstos cambian de un valor inicial a uno final, se dice que ha ocurrido un Cambio de Estado.
6 - VARIABLES TERMODINAMICAS:
Las Variables Termodinámicas, Funciones de Estado o Variables de Estado son cada uno de los parámetros macroscópicos individuales, cuyo significado (físico y químico) es claro y cuya medida es posible, que se emplean para describir el estado de un sistema en equilibrio y tal que sus valores determinan unívocamente el estado del mismo. |
|---|
El número de variables termodinámicas requeridas para especificar el estado de un sistema depende de la naturaleza del mismo y no es siempre conocido. Son muchas las variables termodinámicas que pueden existir en un sistema: la masa y la composición química de cada una de sus partes, los volúmenes, las presiones, las tensiones superficiales, la viscosidad, las constantes dieléctricas, etc. Sin embargo, basta con escoger muy pocas de estas variables para definir de forma unívoca el estado de un sistema, ya que el resto pueden expresarse a partir de las escogidas. En el caso de un gas, estas variables son: la masa
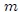 , el volumen
, el volumen 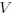 , la presión
, la presión 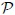 y la temperatura
y la temperatura 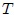 .
.
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
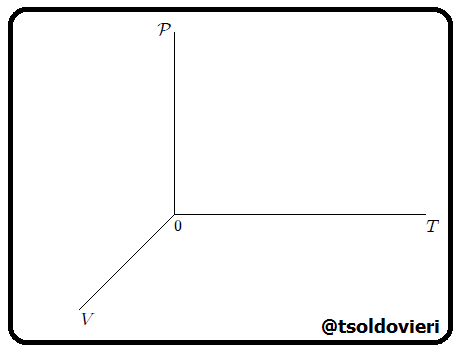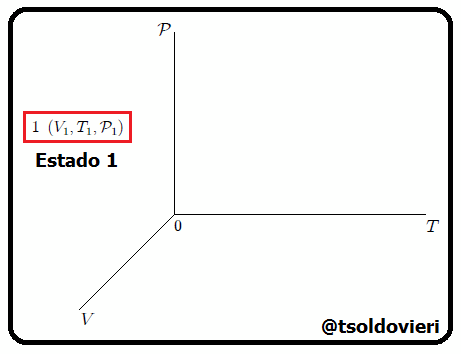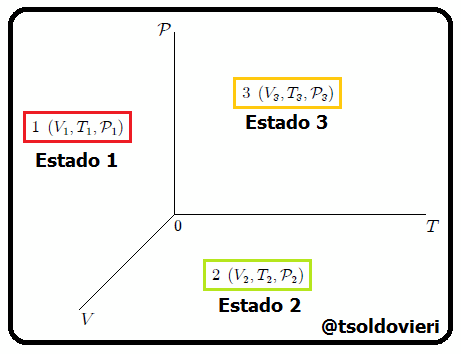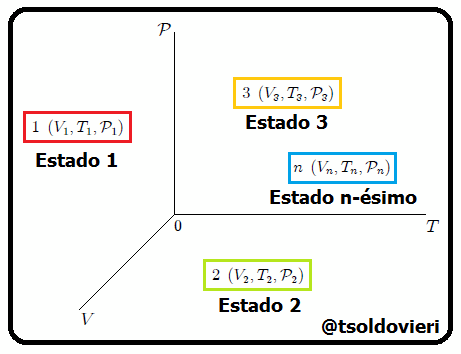
Estimados lectores, luego de muchas experiencias se ha observado que un estado básicamente queda determinado por los valores que en un momento dado tengan la presión, la temperatura, el volumen y el resto de propiedades se expresan en función de ellas. En la figura 2 les muestro una representación de lo antes dicho. En esta figura se representan los estados 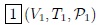 ,
, 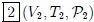 ,
,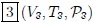 ,...,
,...,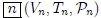 de un hipotético sistema termodinámico. A las gráficas de evolución del estado de un sistema obtenidas con estas tres variables se les denominan Diagramas PVT.
de un hipotético sistema termodinámico. A las gráficas de evolución del estado de un sistema obtenidas con estas tres variables se les denominan Diagramas PVT.
Mis estimados lectores, muy importante es indicar que las variables termodinámicas sólo están definidas cuando el sistema está en Equilibrio Termodinámico, de lo cual les hablaré más adelante en el presente post. |
|---|
7 - GRADOS DE LIBERTAD:
Los Grados de Libertad de un Sistema son el número mínimo de variables termodinámicas independientes que permiten especificar completamente el estado del sistema. |
|---|
El número de grados de libertad de un sistema, mis muy estimados amigos lectores, depende de la complejidad del mismo. Los sistemas que poseen dos grados de libertad reciben el nombre de Sistemas Simples. Por ejemplo, un gas confinado, un alambre tenso, un sólido paramagnético, una sustancia pura y homogénea, etc.
8 - CLASIFICACION DE LAS VARIABLES TERMODINAMICAS:
Mis atentos lectores, las variables termodinámicas se clasifican en:
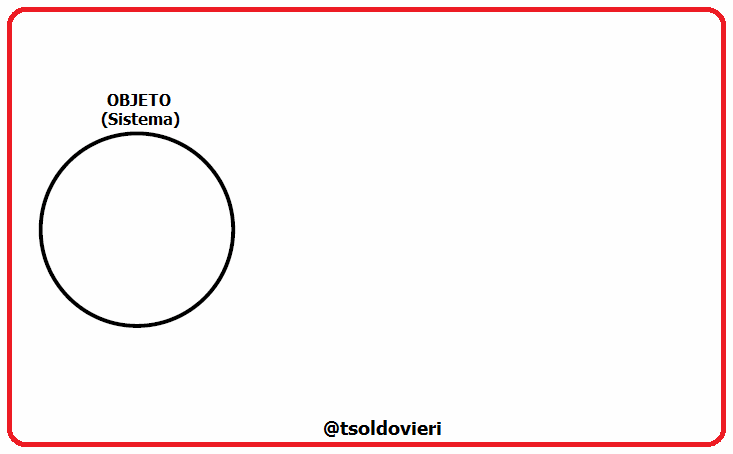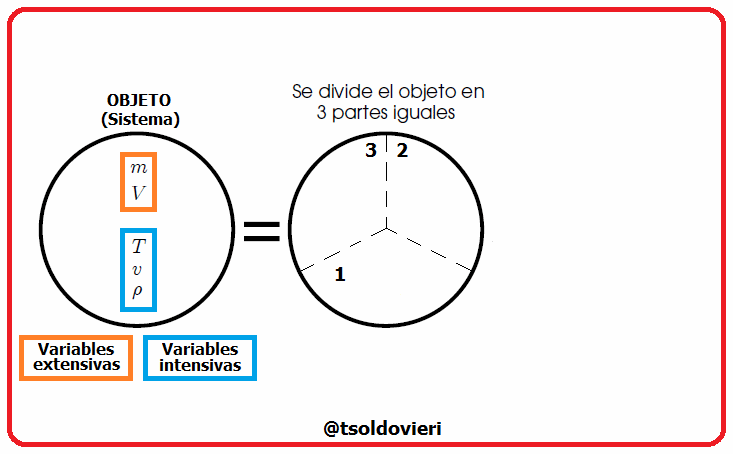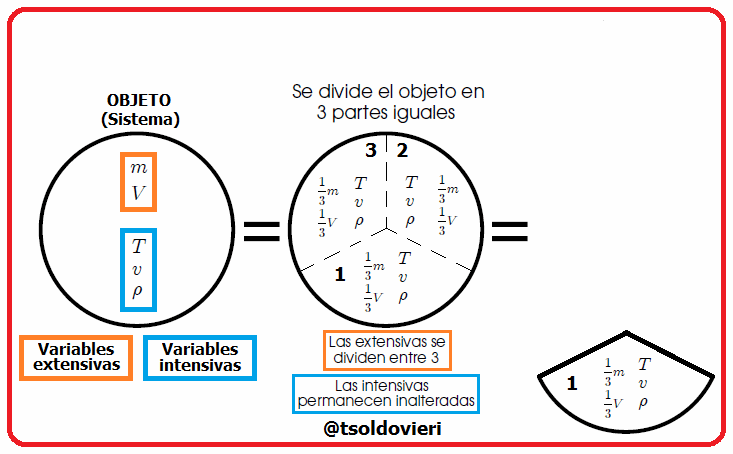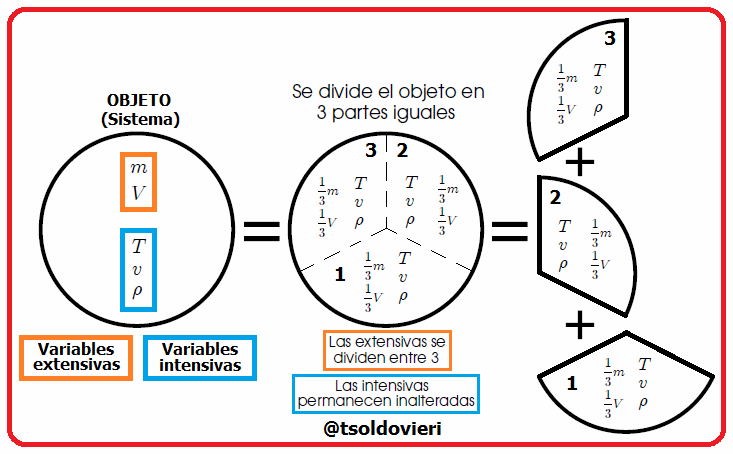
8.1 - EXTENSIVAS:
Son aquellas variables termodinámicas cuyo valor es proporcional al tamaño y cantidad de materia del sistema que describen. |
|---|
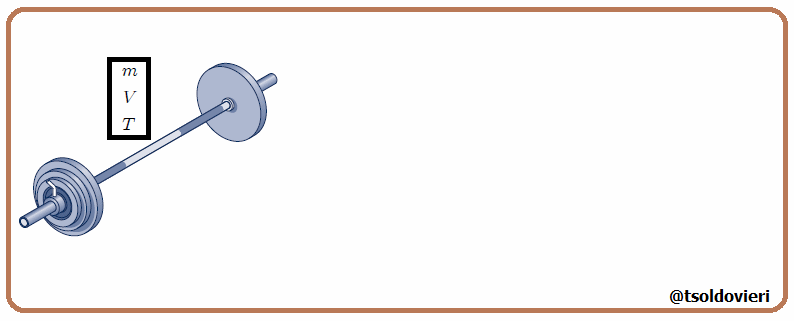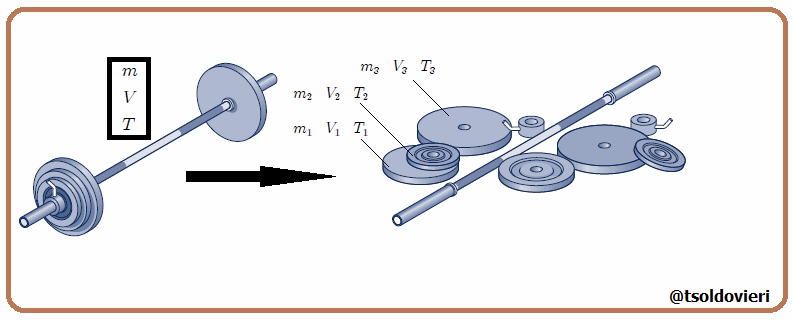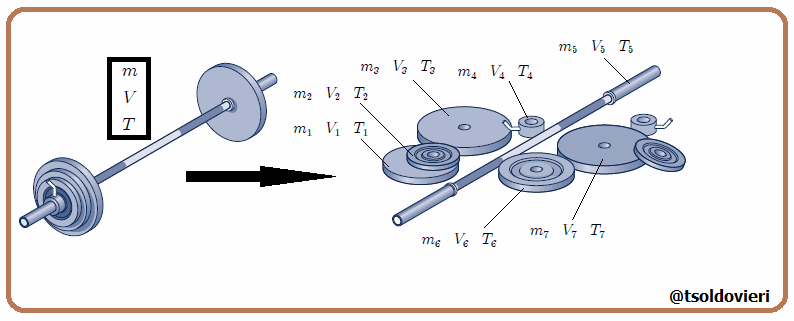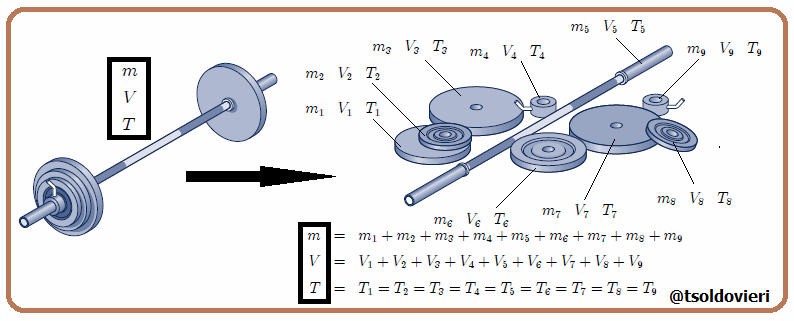
Estas magnitudes pueden ser expresadas como suma de las magnitudes de un conjunto de subsistemas que formen el sistema original, como les muestro en la figura 3. En esta figura 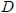 representa una variable termodinámica extensiva cualquiera, por lo que debe cumplirse que,
representa una variable termodinámica extensiva cualquiera, por lo que debe cumplirse que,
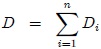
siendo en este caso el número de variables termodinámicas 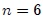 . Ejemplos de variables termodinámicas extensivas son la masa
. Ejemplos de variables termodinámicas extensivas son la masa  , el volumen
, el volumen 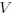 el número de moles
el número de moles 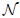 , la energía
, la energía 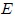 , la entropía
, la entropía 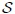 (vean el enlace Entropía para saber un poco más de esta variable termodinámica), etc.
(vean el enlace Entropía para saber un poco más de esta variable termodinámica), etc.

Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
8.2 - INTENSIVAS:
Son aquellas variables termodinámicas cuyo valor no depende del tamaño o masa del sistema. |
|---|
La temperatura 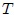 , la presión
, la presión 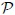 , la densidad de masa
, la densidad de masa 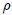 , la imanación (momento magnético por unidad de volumen), la tensión superficial, el punto de fusión, el punto de ebullición y el índice de refracción son variables intensivas.
, la imanación (momento magnético por unidad de volumen), la tensión superficial, el punto de fusión, el punto de ebullición y el índice de refracción son variables intensivas.
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Mis estimados amigos lectores, en la figura 4 les muestro cómo podemos distinguir entre las variables extesivas e intensivas. Dividamos un objeto (sistema) en 3 partes iguales. Las variables intensivas de las 3 porciones (temperatura 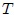 , volumen específico
, volumen específico 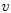 y densidad
y densidad 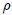 ) permanecen inalteradas, mientras que las variables extensivas (masa
) permanecen inalteradas, mientras que las variables extensivas (masa 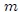 y volumen
y volumen 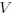 ) tienen la tercera parte de su valor original.
) tienen la tercera parte de su valor original.
Veámoslo ahora de esta manera. Consideremos, mis estimados amigos lectores, una cantidad de materia que es uniforme en temperatura e imaginen que está compuesta de varias partes, como les ilustro en la figura 5. La masa del todo es la suma de las masas de las partes y el volumen general es la suma de los volúmenes de las partes. Sin embargo, la temperatura del conjunto no es la suma de las temperaturas de las partes, es la misma para cada parte. La masa y el volumen son variables extensivas, pero la temperatura es una variable intensiva.
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Cuando se desea obtener resultados independientes del tamaño del sistema, se procede a convertir variables extensivas en intesivas. Se pueden obtener variables intensivas a partir del cociente de dos variables extensivas:
1- El Valor Específico Medio 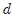 de una variable extensiva
de una variable extensiva 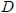 , que es el cociente entre ésta y otra variable extensiva. Esta última suele ser el volumen
, que es el cociente entre ésta y otra variable extensiva. Esta última suele ser el volumen 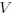 o la masa
o la masa 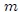 del sistema. De esta manera, cuando el cociente se hace con respecto al volumen se tiene que,
del sistema. De esta manera, cuando el cociente se hace con respecto al volumen se tiene que,
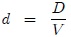
que es una variable intensiva. Si se hace con respecto a la masa se tiene que,
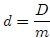
En particular, el Volumen Específico Medio 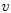 se define como,
se define como,
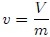
que es una variable intensiva. Como 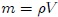 entonces,
entonces,
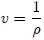
Son ejemplos de los anteriores casos: la masa por unidad de volumen 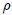 (densidad), la energía por unidad de masa, la entropía por unidad de masa, etc.
(densidad), la energía por unidad de masa, la entropía por unidad de masa, etc.
2- El Valor Molar Medio 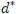 de una variable extensiva
de una variable extensiva 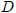 que es el cociente entre ésta y el número de moles
que es el cociente entre ésta y el número de moles  del sistema,
del sistema,
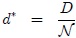
que es una variable intensiva. Como el número de moles 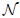 es el cociente entre la masa
es el cociente entre la masa 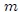 en gramos de la sustancia contenida en el sistema y su Masa Molecular
en gramos de la sustancia contenida en el sistema y su Masa Molecular 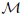 ,
,
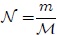
entonces al sustituir esta cantidad en (6) resulta,
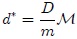
y al sustituir aquí 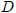 a partir de (2) se obtiene,
a partir de (2) se obtiene,
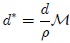
que muestra la relación existente entre el valor específico medio y el valor molar medio. Son ejemplos de este tipo de variables: el Volumen Molar Medio 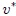 se define como,
se define como,
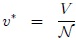
la capacidad calorífica molar, etc.
En general se utilizan letras minúsculas para designar los valores molares o específicos.A diferencia de las variables intensivas presión, temperatura, etc., que caracterizan el equilibrio mutuo de los subsistemas de un sistema, estas variables específicas no son iguales, en general, en las distintas fases de un sistema en equilibrio heterogéneo.
Otra clasificación de las variables termodinámicas, mis amigos lectores, es la siguiente:
8.3 - EXTERNAS:
Las variables termodinámicas externas expresan el acoplamiento del sistema objeto de estudio con su entorno y dependen de la posición de los cuerpos externos al mismo. |
|---|
Por ejemplo, el volumen de un gas encerrado en un cilindro provisto de un pistón depende de la posición de este último; por consiguiente, dicho volumen es una variable externa. Lo mismo ocurre con el campo magnético en el interior de un sistema, ya que éste depende de la posición del sistema respecto de la fuente del campo.
8.4 - INTERNAS:
Las variables termodinámicas internas son aquellas que dependen directamente de la distribución y estado de movimiento de las partículas que constituyen al sistema, dependiendo única e indirectamente de la posición de éste respecto de otros cuerpos externos y, por lo tanto, de las variables termodinámicas externas. |
|---|
Por ejemplo, son variables termodinámicas internas, la presión de un gas, la temperatura, la energía, etc.
Las variables termodinámicas de un sistema solamente están definidas, con claridad y en todos los instantes, dentro del equilibrio termodinámico. En general, los sistemas fuera del equilibrio no pueden ser representados por un número finito de grados de libertad y su descripción es mucho más compleja. |
|---|
9 - EQUILIBRIO TERMODINAMICO:
9.1 - DEFINICION DE EQUILIBRIO TERMODINAMICO:
Mis estimados y amigos lectores, hay muchos tipos de equilibrio. Un sistema se encuentra en Equilibrio Mecánico cuando no se producen movimientos en el sistema. Les ilustraré un caso donde se da equilibrio mecánico. Consideren, mis estimados lectores, dos tanques de gas conteniendo volúmenes de aire a presiones que pueden ser iguales o diferentes, como les ilustro en la figura 6. Estos dos tanques se encuentran unidos por un cilindro, en el interior del cual se encuentra un pistón que puede deslizarse a lo largo del tubo. Inicialmente el pistón está sujeto externamente con una llave. En un momento dado se libera el pistón. Si, al liberar el pistón, éste comienza a desplazarse, llegamos a la conclusión de que las presiones de los gases a ambos lados son diferentes. No sabemos cuánto valen ni las presiones ni su diferencia, sólo que no son iguales. Si, por el contrario, al liberar el pistón, este se queda en el mismo sitio, llegamos a la conclusión de que la presión a ambos lados es la misma, aunque no sabemos cuánto vale. En ese caso los dos tanque están en equilibrio mecánico.
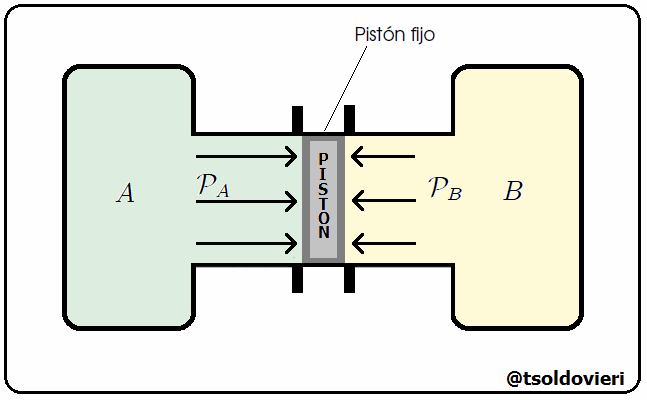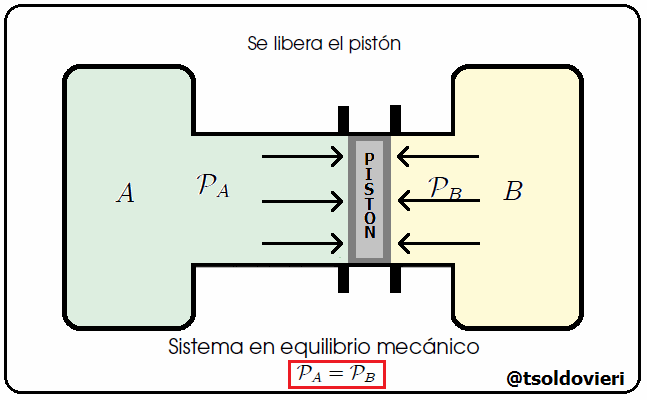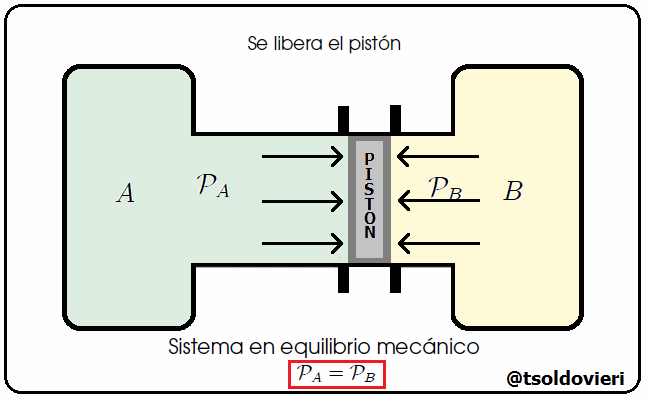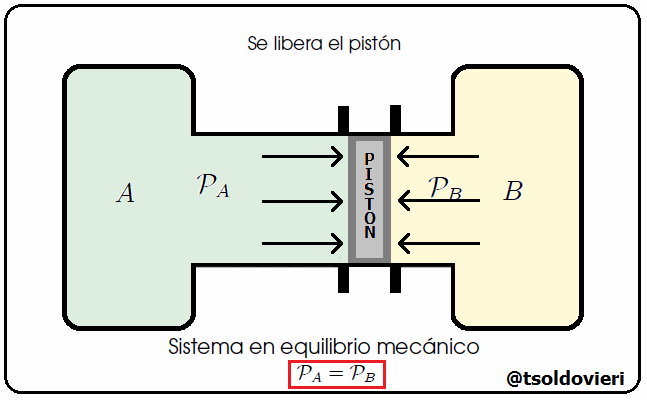
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Por otro lado, mis amigos lectores, un sistema se encuentra en Equilibrio Térmico si el sistema no cambia su temperatura con el transcurrir del tiempo.

Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Consideremos entonces, mis estimados lectores, dos sistemas A y B en contacto térmico, dispuestos de tal forma que no puedan mezclarse o reaccionar químicamente (Vean la figura 7). Consideremos además que estos sistemas están colocados en el interior de un recinto donde no es posible que intercambien calor con el exterior ni existan acciones desde el exterior capaces de ejercer trabajo sobre ellos. La experiencia indica que al cabo de un tiempo estos sistemas alcanzan un estado de equilibrio térmico recíproco. A partir de ese momento cesaran los cambios que pueden detectarse macroscópicamente y no obstante que la actividad continúa, de algún modo el estado macroscópico ha llegado al equilibrio y se caracteriza porque ambos sistemas tienen la misma temperatura.
Ahora bien, mis estimados y amigos lectores, un sistema se encuentra en Equilibrio Químico si su composición química no cambia con el tiempo, es decir, si no ocurren reacciones químicas (que su composición no cambie).
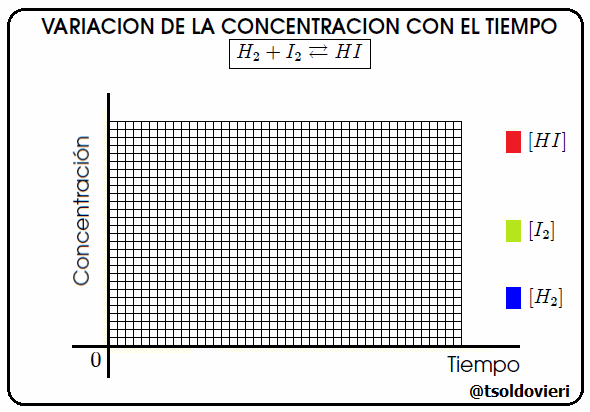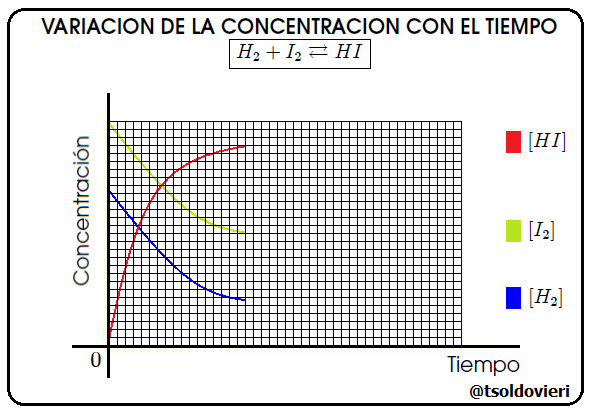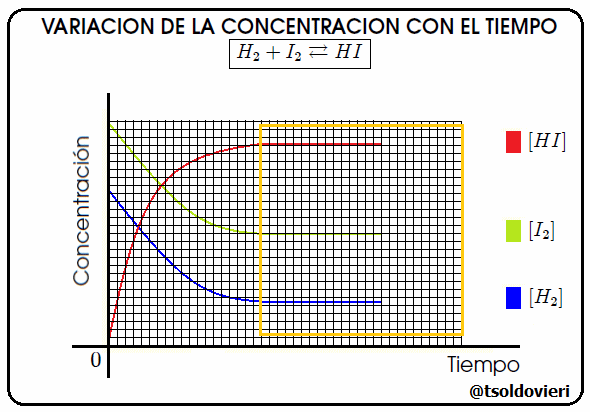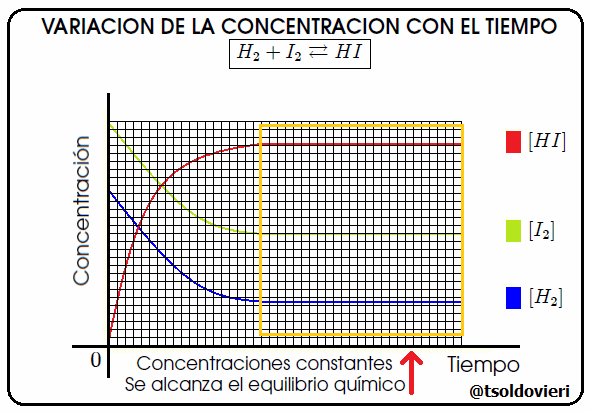
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
En realidad, el equilibrio químico, es una reacción que nunca llega a completarse, pues se produce simultáneamente en ambos sentidos (los reactivos forman productos, y a su vez, éstos forman de nuevo reactivos). Cuando las concentraciones de cada una de las sustancias que intervienen (reactivos o productos) se estabiliza, es decir, se gastan a la misma velocidad que se forman, se llega al químico. En la figura 8 les ilustro el caso de la reacción 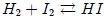 , notándose que en el cuadro amarillo se llega al momento antes mencionado. En la figura [ ] significa "concentración de".
, notándose que en el cuadro amarillo se llega al momento antes mencionado. En la figura [ ] significa "concentración de".
Por último, mis atentos lectores, si en un sistema hay dos o más fases entonces se encuentra en Equilibrio de Fases cuando la masa de cada fase alcanza un nivel de equilibrio y permanece allí.
El equilibrio de fases, mis estimados lectores, se refiere al estudio del equilibrio que existe entre o en los diferentes estados de la materia; es decir sólido, líquido y gaseoso. El equilibrio de fases se define como una etapa donde el Potencial Químico de cualquier componente presente en el sistema permanece estable con el tiempo. La fase es una región en la que la interacción intermolecular es espacialmente uniforme o, en otras palabras, las propiedades físicas y químicas del sistema son iguales en toda la región. Dentro del mismo estado, un componente puede existir en dos fases diferentes, como los alótropos de un elemento. Además, dos compuestos inmiscibles en el mismo estado líquido pueden coexistir en dos fases.
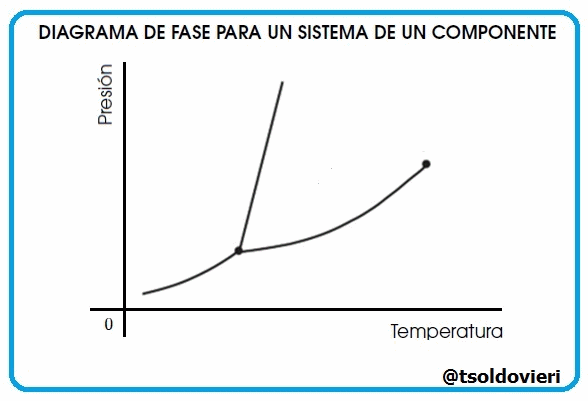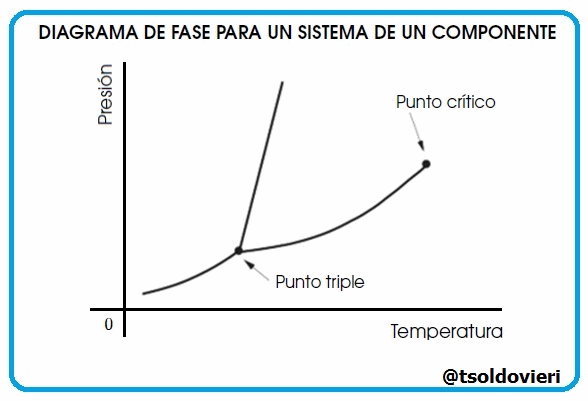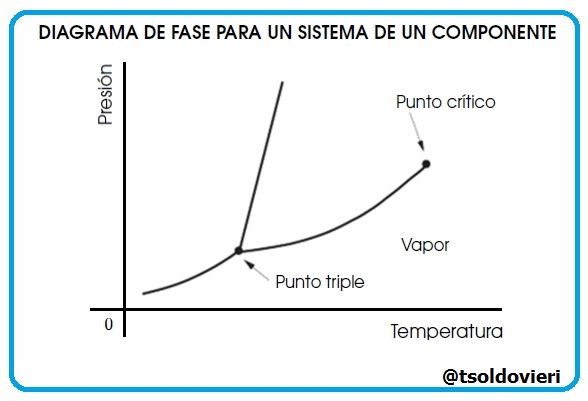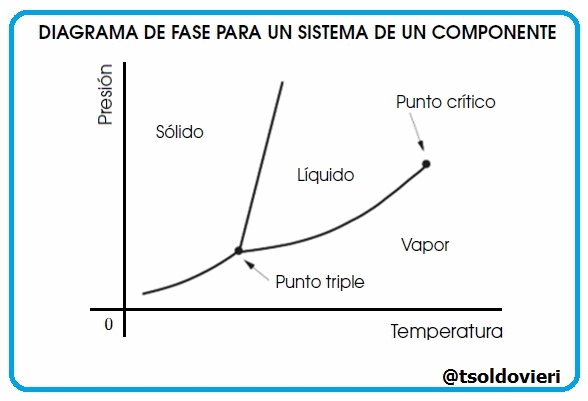
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Lectores todos, las curvas que les muestro en la figura 9 representan la coexistencia de dos fases. La curva de fusión es la curva en el diagrama de fase a lo largo de la cual la fase sólida y líquida de un sistema se mantiene en equilibrio. La fase líquida y gaseosa de un sistema permanece en equilibrio a lo largo de la curva de vaporización, mientras que la curva de sublimación representa la etapa de equilibrio entre la fase sólida y la fase gaseosa. El punto triple es el punto en la gráfica donde los tres estados coexisten y es único para cada componente.
El Equilibrio Termodinámico, atentos lectores, es el estado que alcanza un sistema cuando se satisfacen simultáneamente el equilibrio térmico, químico, mecánico y de fase, no teniendo tendencia por sí mismo para cambiarlos. En este estado no se observa ningún cambio, en todo el espacio de una misma fase de un sistema, de sus variables termodinámicas intensivas a lo largo del tiempo. |
|---|
Un estado de equilibrio no puede ser modificado sin interacciones desde el entorno.
Para comprobar si un sistema está en equilibrio, mis atentos lectores, habría que aislarlo (imaginariamente) y comprobar que no evoluciona por sí solo. El equilibrio es una abstracción pues los sistemas reales no están nunca en estricto equilibrio. Pero siempre y cuando las variables que describen al sistema y al ambiente que interactúa con él no varíen apreciablemente en la escala de tiempo de las mediciones, se puede considerar que el sistema está en equilibrio y aplicarle las consideraciones termodinámicas pertinentes. Se debe notar que un sistema puede estar en equilibrio con respecto de ciertas variables, pero no con respecto de otras. Por ejemplo, si se mezclan hidrógeno y oxígeno gaseosos a temperatura ambiente, la mezcla no queda en equilibrio respecto de la composición química (pues a temperatura ambiente, la reacción de formación de agua 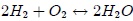 se produce con extrema lentitud) aunque casi de inmediato queda en equilibrio respecto de la presión, el volumen y la temperatura.
se produce con extrema lentitud) aunque casi de inmediato queda en equilibrio respecto de la presión, el volumen y la temperatura.
El Estado de Equilibrio, amigos lectores, se establece en el sistema cuando las condiciones externas son constantes y se mantiene en él durante un tiempo arbitrariamente largo. Se caracteriza por la anulación por compensación de flujos de intercambio y la homogeneidad espacial de los parámetros que caracterizan el sistema que ya no dependen del tiempo. En todas partes del sistema que se encuentra en equilibrio termodinámico, la temperatura es la misma. |
|---|
El equilibrio termodinámico es una propiedad universal de todos los sistemas aislados, pues si un sistema se encierra en un recipiente con paredes aislantes deja de interaccionar con sus alrededores y, por tanto, alcanzará una condición que no variará con el tiempo.
La Termodinámica Clásica se ocupa solamente de sistemas en equilibrio. Esto implica que las relaciones entre las variables termodinámicas de los sistemas (Ecuaciones de Estado) y los cambios que éstas sufren debido a las interacciones con sus entornos, se referirán exclusivamente a condiciones de equilibrio. |
|---|
Un estado de no equilibrio, estimados amigos lectores, es aquél con intercambios netos de masa o energía y sus variables termodinámicas dependen, en general, de la posición y del tiempo. Si no dependen de este último, necesitan la intervención del entorno para mantener sus valores (Estado Estacionario Fuera del Equilibrio).
Si un sistema no está en equilibrio térmico en un momento, no es posible siquiera asignar una presión o una temperatura al sistema. Por ejemplo, si se calienta una olla de agua sobre una estufa, distintas partes del agua registrarán diferentes temperaturas (que pueden no estar cláramente definidas y cambiarán continuamente), no es posible asignar una temperatura a la olla como un todo hasta que cesa el calentamiento y el agua por último alcance una temperatura uniforme, sólo entonces estará en equilibrio térmico.
9.2 - CLASES DE EQUILIBRIO:
Mis estimados lectores, al igual que en Mecánica, en Termodinámica pueden existir varias clases de equilibrio: estable, metaestable, inestable e indiferente.
9.2.1 - EQUILIBRIO ESTABLE:
Un estado de equilibrio es estable si pequeñas perturbaciones no permanentes, provenientes del entorno, no logran modificar el estado del sistema una vez desaparecidas.
Ejemplo: el gas encerrado en un cilindro es un estado de equilibrio estable, ya que una pequeña perturbación hace oscilar el émbolo pero éste termina por volver a su posición original.
Se tiene una situación de equilibrio mutuo entre dos sistemas cuando el sistema conjunto formado por ambos sistemas está en equilibrio estable.
9.2.2 - EQUILIBRIO METAESTABLE:
Un estado de equilibrio es metaestable si algunas perturbaciones no permanentes, provenientes del entorno, logran modificar el estado del sistema una vez desaparecidas.
Ejemplo: un material, como el diamante, puede cristalizar en una forma alotrópica que no sea la más estable en esas condiciones. Algunas aleaciones o algunos vidrios son sistemas metaestables que no varían en el tiempo, o lo hacen muy lentamente. En ocasiones, si los tiempos de relajación son muy grandes, se pueden tratar como si fueran estados de equilibrio estable.
9.2.3 - EQUILIBRIO INESTABLE:
Un estado de equilibrio es inestable si perturbaciones ínfimas, provenientes del entorno, logran modificar el estado del sistema una vez desaparecidas.
Ejemplo: un líquido subenfriado, que permanece líquido por debajo de su punto de congelación, sería un ejemplo de estado inestable.
9.2.4 - EQUILIBRIO INDIFERENTE:
Un estado de equilibrio es indiferente si perturbaciones, provenientes del entorno, logran modificar el estado del sistema una vez desaparecidas y la modificación es proporcional, al menos en un cierto intervalo, a la perturbación.
Ejemplo: un líquido en equilibrio con su vapor es un ejemplo de equilibrio indiferente, pues una ligera disminución del volumen no modifica ni la temperatura ni la presión del sistema y sólo se modifica la distribución de masas entre ambas fases (líquido y vapor).
En Termodinámica, excepto cuando se indique expresamente, se sobreentenderá que los estados de equilibrio con los que se trata son estables. |
|---|
MIS ATENTOS LECTORES, HASTA AQUI LLEGARE EN ESTE POST, CONTINUARE EN UN PROXIMO Y ULTIMO POST ...

BIBLIOGRAFIA RECOMENDADA
Aquí les presento 7 textos que recomiendo si desean ahondar en el tema:
Soldovieri C., T. FISICA GENERAL - UNA INTRODUCCION A LOS FLUIDOS, VIBRACIONES Y TERMODINAMICA. Preprint, 2020. El borrador se puede descargar desde mi web http://www.tsoldovieritsweb.ihostfull.com
Bauer, W. & Westfall, G. D. FISICA PARA INGENIERIA Y CIENCIAS, volume 1. McGraw-Hill/Interamericana de México, S. A. de C. V., 2011.
Bueche, F. J. & Hecht, E. FISICA GENERAL. Schaum. McGraW-Hill / Interamericana Editores, S.A. de C.V., México, 10ma edition, 2007.
Fishbane, P. M.; Gasiorowicz, S. G. & Thornton, S. T. PHYSICS FOR SCIENTISTS AND ENGINEERS WITH MODERN PHYSICS. Pearson Education Inc., 3th edition, 2005.
Burbano de E., S.; Burbano G., E. & Gracia M., C. FISICA GENERAL. Editorial Tébar, S.L., 2003.
Halliday, D.; Resnick, R. & Krane, K. S. FISICA, volume 2. Compañía Editorial Continental, S.A. de C.V., México, 4ta edition, 1994.
Hewitt, P. G. CONCEPTOS DE FISICA. Editorial Limusa, México, 1era edition, 1992.
WEB: https://www.ejemplos.co/30-ejemplos-de-sistema-abierto-cerrado-y-aislado/


Estimados amigos Lectores. Espero que la anterior información les sea de mucha utilidad. Si tienen preguntas, no duden en hacérmelas llegar pues, con mucho gusto, les atenderé. Igualmente, si tienen detalles que puedan nutrir o mejorar la anterior información, por favor, háganmelas saber. Hasta la siguiente parte del presente post ¡Saludos a todos! 😁.
LES INVITO VISITAR MI WEB PERSONAL www.tsoldovieritsweb.ihostfull.com
En esta página web podrás conseguir los borradores de los libros de texto que estoy escribiendo y varias listas de problemas con respuestas de: Optica, Mecánica Clásica, Mecánica Cuántica, Física General 1, Física General 2 y Física General 3. También encontrarás enlaces a otras páginas web de interés.
Deja tus comentarios en el libro de visitas! 😁

Saludos mi estimado amigo @tsoldovieri, que bueno verte de nuevo ahora por Hive, siempre con excelentes publicaciones, espero te encuentres bien, seguimos en comunicación !
Gracias por la bienvenida amigo @amentyj y gracias por la buena referencia a mis publicaciones. Espero, igualmente, que te encuentres muy bien. Saludos.
Saludos, bastante buena su explicación en cuanto a las variables extensivas e intensivas. Estos son conceptos básicos sumamente importantes al momento de entender y describir un sistema termodinámico. He notado que el concepto de equilibrio químico siempre se asocia con el equilibrio mecánico, y si bien existen propiedades constantes en el tiempo, el sistema sigue siendo dinámico.
Excelente post, saludos cordiales.
Excelente comentario amigo @aleestra. Gracias por la buena referencia al presente post. Mis saludos cordiales.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.
Thanks for the support @steemstem @stemsocial