La electroquímica se encarga de convertir la energía química en eléctrica, para que esto ocurra debe estar presente una celda o célula electroquímica, entre las que están la celda voltaica y la celda electrolítica. En la primera ocurre una reacción espontánea que produce energía eléctrica y en la segunda se necesita de la energía eléctrica para que ocurra una reacción no espontanea.
En este tipo de celdas se llevan a cabo dos tipos de reacciones de óxido-reducción que intrínsecamente ocurren en dos pasos o dos reacciones, la de reducción que gasta electrones y la de oxidación que los produce. Cabe recordar la primera ley de la termodinámica que establece que la energía o materia no puede crearse ni destruirse solo se transforma. Entonces el número de electrones no puede cambiar, es decir, los electrones gastados en la reducción debe ser igual a los generados en la oxidación.
En las celdas o células electroquímicas la Rx de óxido-reducción se lleva a cabo en dos electrodos distintos que puede ser dos placas metálicas como se muestra en la figura 1. Comúnmente conocida como celda de Daniell
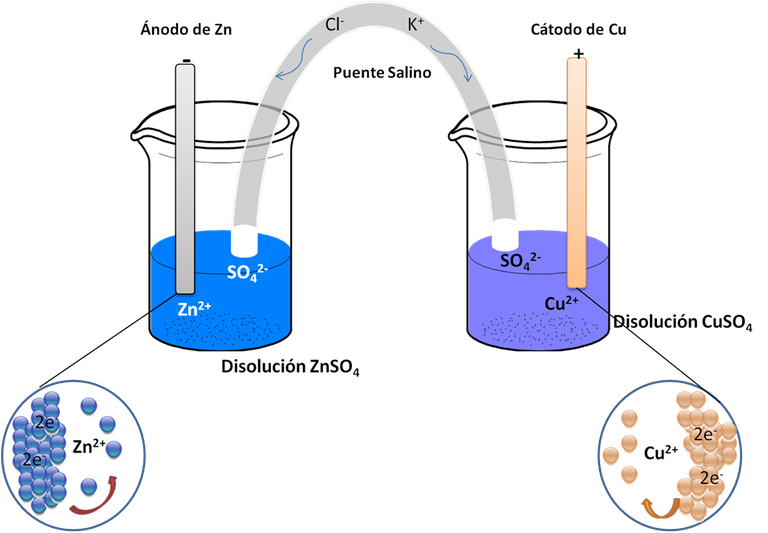 Figura 1. Celda electroquímica de Daniell-Fuente: Elaboración Propia.
Figura 1. Celda electroquímica de Daniell-Fuente: Elaboración Propia. La reacción de reducción ocurre en el cátodo, desplazando los aniones al ánodo. Mientras que en el ánodo pasa la oxidación moviendo los cationes al cátodo. Como se observa una placa de Zinc es sumergida en una solución de sulfato de Zinc. La placa metálica es oxidada a iones de Zn+2 mientras que los iones de cobre son reducidos a cobre metálico.
CELDAS VOLTAICAS
Debido a que las celdas volticas requieren de una reacción espontánea, cualquier reacción redox (Oxido-reducción) puede servir para generar energía en estas celdas. Estas están diseñadas como se explicó en la celda de Daniell. Donde los electrones son movidos por un sistema externo donde ocurre el trabajo eléctrico. Llamado puente salino que está situado de forma tal que conecta ambas soluciones, este generalmente está constituido por un tubo en forma de U con un corcho de fibra de vidrio en cada lado, lleno con una solución salina como cloruro de potasio. Las barras metálicas actúan como electrodos.
Con el transcurrir de la reacción, se genera un flujo continuo de electrones que producen la electricidad (Este tipo de trabajo eléctrico son los que impulsan un motor). En estos casos el flujo de corriente eléctrica se dirige del ánodo al cátodo por la diferencia de los potenciales eléctricos en los electrodos. Para entender mejor esto, deben imaginarse una cascada de agua donde el agua transcurre en una sola dirección por la diferencia de la energía gravitacional. Volviendo a las celdas voltaicas esta diferencia del potencial eléctrico es determinada por un voltímetro convencional.
Las células voltaicas tienen una característica y es su potencial estándar que se define como la fuerza conductora de dicha rx, que no depende de la cantidad de electrones implicados sino de la naturaleza de esta y de las especies presentes. Este es medido cuando las intensidades de la corriente eléctrica son nulas.
CELDAS ELECTROLÍTICAS
Por otra parte están las celdas electrolíticas las cuales necesitan de una contribución eléctrica para que se lleven a cabo las reacciones no espontaneas. Como se muestra en la Figura 2. Donde la fuente de energía que se muestra a la izquierda del beacker es conectada a los electrodos sumergidos en la solución de sulfato de Zinc.
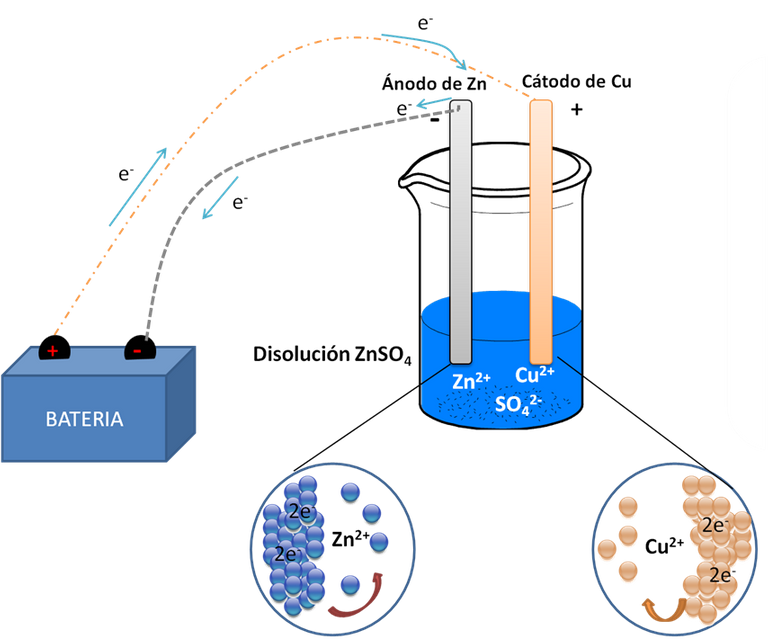
Figura 2. Celda electrolítica-Fuente: Elaboración Propia.
Esta batería es un generador de electrones que los traslada del cátodo al ánodo. Este proceso necesita que los electrones sean consumidos en el cátodo para poder producirse en el ánodo para garantizar la neutralidad. Como en una reacción Redox, y cuando esto sucede en una celda de este tipo el proceso de denomina electrólisis
La electroquímica tiene varios propósito depende del campo donde se empleen, por ejemplo para los químicos es de mucha ayuda porque ayuda a predecir si las reacciones son espontaneas o no, la potencia de las especies oxidantes y reductoras y algunas concentraciones en disoluciones. Por otro lado están los ingenieros que aprovechan los depósitos electrolíticos y la electrolisis producidas por estas celdas. Y finalmente se encuentran los no relacionados con estas aéreas, que utilizan estos materiales en instrumentos como pilas, marcapasos y automóviles.
CELDAS DE FLUJO
Las celdas de flujo son comúnmente unas baterías de energía renovable (recargable), que es generada por elementos químicos diluidos en un sistema y distanciados por una especie de membrana permeable que permite el paso de iones y electrones que transportan la corriente eléctrica, sin permitir el contacto de los dos líquidos como se muestra en la figura siguiente. Este tipo de celdas es similar a las mencionadas anteriormente.
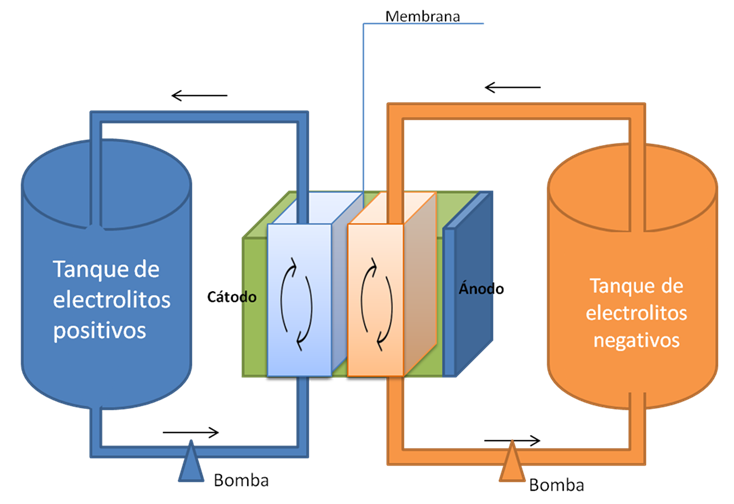 Figura 3. Celda de flujo- Fuente: Elaboración propia
Figura 3. Celda de flujo- Fuente: Elaboración propia Alguna de las aplicaciones que presenta esta celda, es que puede producir energía eléctrica a partir de fuentes naturales como el sol y el viento. En los últimos años se han diseñado vehículos eléctricos basados en estas celdas.
APLICACIONES
Las pilas que comúnmente utilizamos en casa, en un control remoto de televisor, en una linterna o en un juguete infantil manejan este tipo de sistemas. Entre las que se destacan
Pila Voltaica (No recargable)
Como se muestra en la ilustración, en una pila seca, contiene una lámina de Zn que es el ánodo, mientras que un barrote de grafito que pasa a lo largo de esta actúa como el cátodo. La separación entre los electrodos es saturado con una mezcla de dióxidos de manganeso, cloruros de zinc y cloruros de amonios.
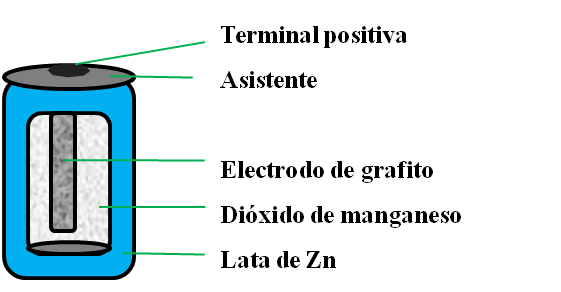
Figura 4. Pila seca-Fuente: Elaboración Propia
Si la pila esta en uso la reacción en el ánodo es
Zn(s) --- Zn2+(ac) + 2e-
Y en el cátodo Por lo que la reacción global ocurrida en la pila en funcionamiento es: Zn(s) 2MnO2(s) + 2NH4(ac) --- Zn2(ac) + Mn2O3(s) + 2NH3(ac) + H2O Una aplicación directa son las baterías que utilizan los automóviles para funcionar que están compuesta por 6 celdas voltaicas. Estas pilas pueden ser recargadas repetidas veces debido a que los productos de las rxs se sitúan en los electrodos. Al ser conectados a una fuente de energía alterna, esta hace que se restablezcan las condiciones iniciales y vuelva a ocurrir las reacciones redox.
2MnO2(s) + 2NH4(ac) + 2e-----Mn2O3(s) + 2NH3 (ac) + H2O
Pila Voltaica (Recargable)
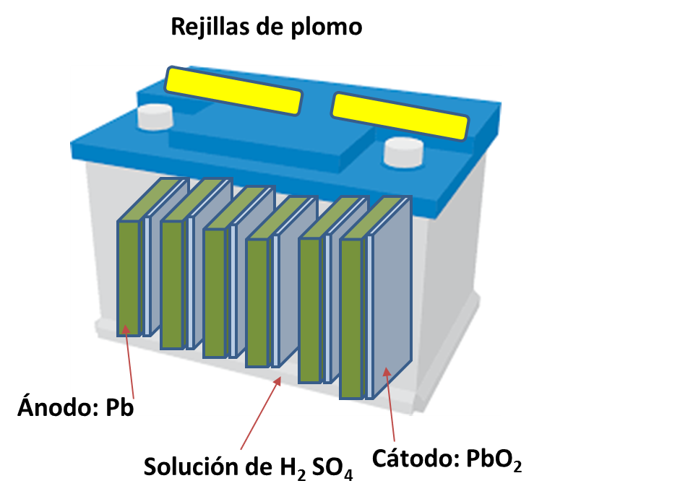
Figura 5 Batería de plomo.
Como se muestra en la figura, el ánodo está constituido por láminas de plomo y saturada con plomo en gel, mientras que el cátodo es similar pero relleno con oxido de plomo todo sumergido en ácido sulfúrico la reacción que ocurre en las baterías de este tipo es:
Pb(s) + PbO(2)(s) + 4H+ + 2SO4-2(ac) --- 2PbSO4(s) + 2H2O
Automóvil Quant
En los últimos años se ha diseñado un automóvil eléctrico basado en las celdas de flujo detalladas arriba. Estas celdas están constituidas por una solución acuosa de electrolitos para generar la energía eléctrica. Estas baterías le dan la capacidad al carro de recorrer hasta 600 kilómetros con una sola recarga. Los electrolitos provienen del agua de mas, que es rica en sales metálicas. Este carro cuenta con dos tanques que actúan como depósito de los electrolitos y estos están unidos por una membrana semipermeable capaz permitir el acceso de los protones de uno hacia el otro tanque. En este proceso de traslado, es decir, cuando las reacciones redox tienen lugar se convierte la energía química en eléctrica y hacer que el coche se mueva.
Como podrán notar casi todas las imágenes fueron de mi autoría debido a que no encontré en internet imágenes alusivas que se encontraran libres de los derechos de autoría.
Nota: La figura 5 fue modificada para esquematizar la batería.
Referencias
1 Masterton W.L; Hurley C. N.; Principios y reacciones químicas, cuarta edición, pagina 501.
2 Engel T.; Reid P.; Química Física, paginas 239
Excelente información. Gracias por compartir con la comunidad.
Las reacciones redox siempre han sido unas de mis favoritas, por esa capacidad de como una reacción química puede generar electricidad y viceversa, estos procesos son más comunes de lo que creemos, las baterías de nuestros celulares son un ejemplo de ello. Gracias por compartir este tema tan interesante, ya veo que también te gusta la electroquímica. Saludos!!!
Las imágenes te quedaron excelentes ;)
Estimado @joseleogon. Ciertamente es muy interesante este campo por todas las aplicaciones que nos presenta y que tanto utilizamos. El que mas personas entiendan como funcionan algunos aparatos de uso común me agrada y por eso lo comparto. Gracias por lo de las imágenes me costaron mucho jejeje, pero lo logre.
Y lograste un buen trabajo!
definitivamente las reacciones reox juegan un papel importante en nuestra vida, saludos excelente post..
Hola @faneitejose. Mucha razón tienes. Gracias por leer y comentar.
Extraordinario articulo. Soy del área de ciencias sociales, pero hoy gracias a ti aprendí algo nuevo. Éxitos y felicidad.
Hola @conkamil me alegra saber que que se entendió para profesionales de otras áreas. Gracias por leer y comentar.
La química para mi es un misterio interesante, es capaz según los textos histórico que los llamados alquimista podían convertir un metal en oro, claro en esta época eso no se ha podido comprobar imaginen si eso fuera posible, estuviéramos en tremendo lió las naciones del mundo, es mejor seguir sacándolo de la minas naturalmente así tiene mas valor. saludo amiga seguiremos en contacto estamos a la orden ....
Hola @frl21. Bueno los alquimistas fueron los pioneros en la química, solo que no sabían que estaban haciendo ciencia y muchas personas los creía brujos. ejejejeje
Buen post amiga @viannis. Realmente la electroquímica tiene muchas aplicaciones, no es mi área favorita jaja. Bien que explicas como se aprovechan en beneficio de algunos aparatos de uso tan común. Saludos!
Cierto estimado @emiliomoron. Sin saber que es química siempre los utilizamos.
muy buen post , Las reacciones redox no son mi fuertes ya que no son mi fuerte en la ing mecánica pero me recordó aquellos tiempo cuando vi química 1 .
Ciertamente es un tema que se estudia al principio de las carreras como química e ingeniería . gracias por leer y comentar. saludos
Excelente explicación estimada Viannis, esto solo hace que mi creencia de que la ciencia posee las respuestas a todo aumente, gracias por compartir, tratare de hacer un experimento así en casa jeje. Saludos
Claro que puedes hacer tu experimento en casa es sencillo de hacer. Sí creo que la ciencia expliqué muuuchsimás cosas. tal vez 99% pero no todas. Saludos
Hola @viannis excelente explicación y las imágenes están bien didácticas acorde a tus descripciones. Feliz día
Gracias por leer y comentar
guaoo de masiado genial este post gracias @viannis
Gracias amigo @luisrigual
Hace rato que quería pasarme a leer tu artículo y por cuestiones de tiempo no había podido, como siempre estimada @viannis excelente trabajo, se nota la dedicación que le pones a cada uno de tus posts. Las imágenes están brutales. Saludos.
Estimada @mayterevilla gracias por leer y comentar. Y pues intento esforzarme mas en cada post.
Excelente post. una buena contribución y super bien ilustrada
Saludos amiga @geadriana gracias por leer y comentar.
Excelente post. Tengo una curiosidad: ¿Qué programas utilizas para elaborar esas imágenes?. Te quedan espectaculares.
Hola estimado @josedelacruz. Realmente la mayoría de esas imágenes fueron construidas en power point empleando diferentes formas geométricas, a excepción de los beacker que los construí usando ChemDraw que es un emulador de reacciones químicas, es muy útil para diagramar toda clase de compuestos químicos y experimentos.
Gracias @viannis. Saludos.
Extraordinario post @viannis donde muestras de manera didáctica la forma en que la química está presente en la cotidianidad de nuestras vidas. Tu explicación es comprendida por expertos y público en general, debido a a la utilización del léxico científico con sentido pedagógico. te felicito por ello; además es un tema interesante apoyado por muy buenas ilustraciones. Espero que en próximos post pudieras mostrarnos cómo montar una actividad práctica con esta temática. Felicitaciones y éxitos.
Estimado @tomastonyperez gracias tan buen comentario. Y gracias por esa idea de mostrar en la práctica como montar una celda electroquímica. La tomare en cuenta y trabajare en mi laboratorio para mostrarle en un vídeo como hacerlo. Saludos
Excelente explicación de la electroquímica, está a nuestro alrededor, convivimos con ella a diario, sin embargo, no la conocemos! gracias por el aporte! te animo para que te añadas al grupo de #cervantes ciencia, de seguro serás una gran aliada de sus publicaciones.
Gracias por tu comentario y la invitación. Pasare por alli a leer las normas de esta nueva comunidad.
Excelente trabajo @viannis. Una impecable presentacion de los alcances y aplicaciones de la electroquimica.
Gracias amigo @lorenzor
Saludos @viannis. Que buena publicación donde haces un presentación detallada de las diferentes maneras de producir energía eléctrica a partir de la energía química.
@cuarzo05 Me alegro que les haya gustado mi post.
Gracias.