
Bienvenido a todos aquellos lectores de la comunidad de Hive que les apasiona contenidos de carácter científico asociados a la Química. En esta entrega, estaremos describiendo los fundamentos químicos detrás de un alcoholímetro, los cuales están orientados a las reacciones oxido-reducción que sufren muchos elementos o sustancias presentes en la naturaleza.
INTRODUCCIÓN
Los proceso biológico, se llevan a cabo en su mayoría a través de medio acuoso, donde se pueden evidenciar un conjunto de reacciones químicas que permiten el funcionamiento de los sistemas donde se desarrollan. El termino reacción química, ha sido acuñado en entregas anteriores, donde se establece como el proceso mediante el cual los reactivos se transforman en productos, dando lugar a la formación de nuevas sustancias con características deferentes a las originarias.
Por consiguiente, a nivel experimental, biológico y natural, las reacciones acuosas juegan un papel preponderante ya que están presentes en todas partes. A nivel práctico, las reacciones en fase acuosa son muy importantes, debido a la capacidad que tiene el agua de disolver un gran número de sustancias, generando sustancias iónicas que permiten una fácil interacción y formación de reacciones químicas.
En tal sentido, en esta oportunidad nos centraremos en estudiar el conjunto de reacciones que se pueden llevar a cabo en fase acuosa, concentrándonos en las reacciones redox, con el fin de dar respuesta sobre el funcionamientos químico del alcoholímetro como instrumento usado para evitar accidentes de tránsito.
GENERALIDADES DE LAS DISOLUCIONES EN FASE ACUOSA
Como hemos mencionado en entregas anteriores, las disoluciones son mezclas homogéneas formadas por un soluto y un solvente, donde el soluto es la sustancia que se encuentra en menor cantidad y el solvente es el compuesto que más abunda dentro de las disoluciones.
En función de instruir al lector sobre el comportamiento de las disoluciones, en esta oportunidad hablaremos de solutos electrolíticos, entiéndase como aquella sustancia que se disocia completamente en agua, generado una disolución y que tiene la capacidad de conducir electricidad. Por su parte, los solutos no electrolíticos, no se disocian en agua por consiguiente las disoluciones que generan no tienen la capacidad de conducir la electricidad.
Una demostración práctica, para comprender el fenómeno se lleva a cabo, consiste en hacer circular corriente eléctrica sobre diferentes disoluciones y así evaluar la capacidad de disociación de las sustancias participantes, como se demuestra en las imágenes siguientes.

Autor: @madridbg, editado a través de Power Point 2010
Una vez realizada la experimentación podemos determinar que la capacidad de una disolución de conducir la electricidad, depende de la cantidad de iones disueltos, por lo que es de esperarse que el cloruro de sodio (NaCl) sea el compuesto que demuestra a cabalidad esta propiedad, ya que se disocia de acuerdo a la siguiente ecuación:

La carga positiva y negativa de los iones sodio y cloro se comportan como un puente eléctrico que permiten que el bombillo se encienda.
TIPOS DE REACCIONES QUIMICAS
En este apartado de la temática, haremos un recorrido por las diferentes reacciones químicas que se pueden desarrollar en medios acuosos, dedicando mayor atención a las reacciones de oxidación-reducción (Redox) que nos interesan por fines prácticos para cumplir con lo planteado en el título de esta temática.
En este sentido, realizaremos un breve bosquejo por las reacciones que se producen en fase acuosa.
Reacción de precipitación: Son aquellas que resultan de la combinación de determinados cationes y aniones en disolución, generando sustancias insolubles en agua que tienden hacer sólido, los cuales se depositan en el fondo del recipiente a causa de su propio peso. Las reacciones de precipitación, se utilizan en los laboratorios para identificar los iones presentes en una disolución cuyo principio se fundamenta de acuerdo a la siguiente ecuación.
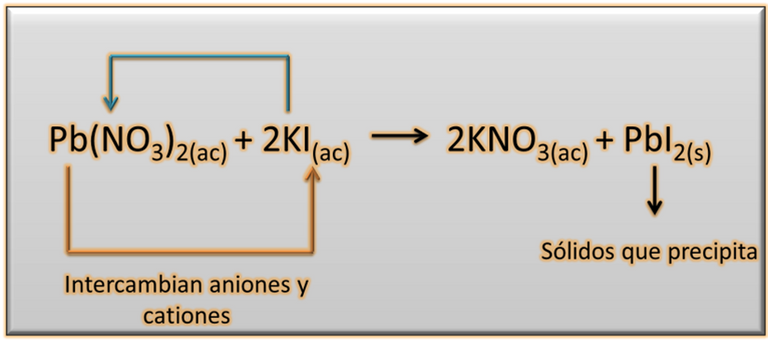
Si analizamos la ecuación, podemos observar que al combinar una disolución acuosa de nitrato de plomo [Pb(NO3)2] con una solución de ioduro de potasio (KI) se obtiene como resultados nitrato de potacio (KNO3) el ioduro de plomo (PbI2) que se precipita durante la proceso, producto del doble desplazamiento de los cationes y aniones presentes en la reacción.
Reacciones ácidos-base:
Este tipo de reacción hace referencia a la utilización de aquellas sustancias que tienen la capacidad de ceder y aceptar electrones, las cuales denominamos ácidos y bases respectivamente. Cuando estas sustancias reaccionan dan lugar a la formación de un compuesto con características iónicas que denominaremos sal más la producción de agua.

Si analizamos la ecuación, podemos observar que una disolución de ácido clorhídrico (HCl) reacciona como una de hidróxido de sodio (NaOH) dando lugar a la formación de cloruro de sodio (NaCl) más agua (H2O).
Reacciones reducción-oxidación (Redox):
Este tipo de reacción se produce como consecuencia de la transferencia de electrones de una sustancia a otra dentro de una disolución, originando una variación en la carga de los átomos que participan.
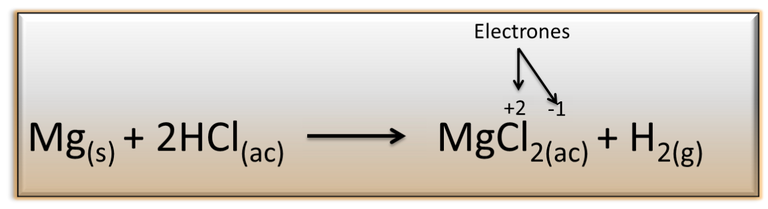
Un ejemplo de las reacciones redox, es la interacciones entre el magnesio (Mg) y el ácido clorhídrico (HCl), donde el magnesio cede uno de sus electrones al cloro para producir cloruro de magnesio (MgCl2) y liberar hidrogeno en forma de gas.
Para comprender el funcionamiento del alcoholímetro, profundizaremos en las reacciones redox. Por consiguiente, es necesario hablar de los estados de oxidación de los átomos, el cual es definido como el número de cargas que tendría un átomo en una molécula (o en un compuesto iónico) si los electrones fueran transferidos completamente. [1]
A través del número de oxidación podríamos evaluar si un elemento se ha oxidado o se ha reducido, a sabiendas de que ha ganado o perdido electrones. A modo de instruir al lector sobre las reacciones redox realizaremos un ejercicio práctico, aplicando los conceptos estudiados hasta el momento.
Ejercicio propuesto:
El óxido de manganeso (MnO2) reacciona con una disolución de ácido clorhídrico (HCl), dando lugar a la formación de iones manganeso (Mn), cloro gaseoso (Cl2) y agua, acuerdo a la siguiente ecuación iónica, determine:
1. Sustancia que se reduce
2. Sustancia que se oxida
3. Agente reductor
4. Agente oxidante

La secuencia a seguir para responder a los planteamientos del ejercicio los detallaremos a través de la siguiente imagen.
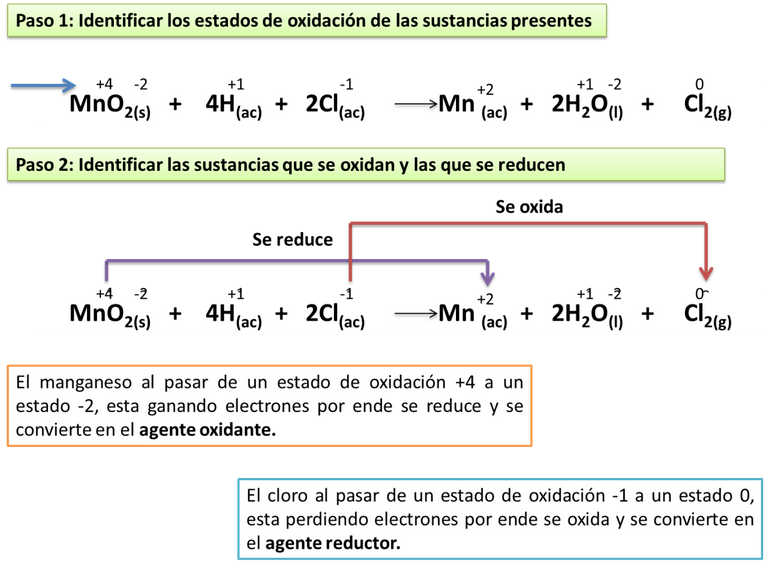
Autor: @madridbg, editado a través de Power Point 2010
En la imagen anterior podemos observar que existen sustancias que se oxidan y otras que se reducen, esto de acuerdo a la ganancia o perdida de electrones como se explicó con anterioridad, de igual manera es importante mencionar que en este tipo de reacción siempre van a participar compuestos neutro, los cuales están presentes en el proceso pero no participan en la variación de carga.
QUIMICA DETRÁS DEL ALCOHOLÍMETRO
A nivel orgánico, existen una gran variedad de compuestos o familia orgánicas, a este respecto hablaremos de los alcoholes, haciendo referencia al etanol que representa el principio fundamental de las bebidas alcohólicas. Estas sustancias, tienen la capacidad de oxidarse y producir ácidos orgánicos.
Por consiguiente, cuando nos someten a la utilización del alcoholímetro lo que están midiendo es la cantidad de ácido acético que se forma producto de la reacción redox entre en dicromato de potasio y el etanol, presente en nuestro cuerpo a causa de las bebidas alcohólicas que consumimos.
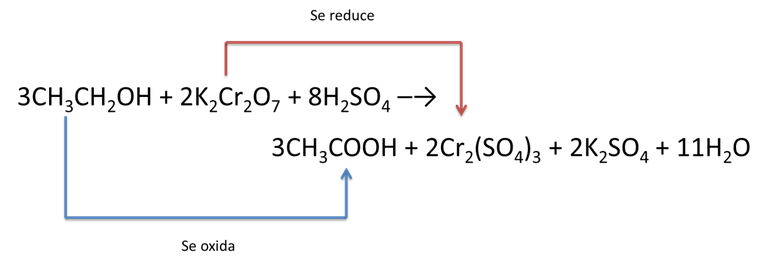
Técnicamente, el aparto detecta la perdida del color anaranjado del ion dicromato el cual pasa a verde. Lo que indica que el cromo (+6) se redujo a cromo (+3) originando la variación del color, por lo que es de esperarse que el dicromato se comporte como un agente oxidante y el etanol será nuestro agente reductor.

Autor. Chang, (2010)
Las medidas regulativas para considerar a un individuo con intoxicación por etanol dependen de las leyes de cada país, sin embargo, una media de referencia que podemos utilizar es de 0,1% de alcohol en sangre por unidad de masa, lo que refleja la concentración del etanol en la sangre y por ente en nuestro sistema.
APORTES DE LA TEMÁTICA
A través de las temáticas de química en contexto, podemos integrar contenidos científicos con aplicaciones diarias de nuestra cotidianidad. En este particular, el tópico permitió abordar los referentes a los tipos de reacciones, haciendo énfasis en las de oxidación y reducción y su aplicación en instrumentos que permite velar por la integridad de los seres humanos.
BIBLIOGRAFÍA CONSULTADA
[1] Chang, R. (2010). Química. Decima edición. McGraw-hill Interamericana editores. ISBN: 978-607-15-0307-7.
[2] Martínez y Col. (2018). El alcoholímetro: Consumo de alcohol en la Feria Nacional de San Marcos 2018. Revista Internacional de Investigación y Formación Educativa
[3] McMURRY E., John y Fay C., Robert. (2008). Química general. Quinta edición PEARSON EDUCACIÓN, México, 2009 ISBN: 978-970-26 1286-5.
[4] Ralph, H. Petrucci, William S. Harwood, E. Geoffrey Herring. (2003). QUIMICA GENERAL. Octava edición. PEARSON EDUCACIÓN. S.A., Madrid.
SITIOS WEB CONSULTADOS
[Wikipedia]( https://es.wikipedia.org/wiki/Alcohol%C3%ADmetro#:~:text=El%20alcohol%C3%ADmetro%E2%80%8B%20o%20alcoh%C3%B3metro,sangre%20o%20en%20un%20gas.)
[Trendy](https://trendydrivers.michelin.es/consejos/como-funciona-un-alcoholimetro)
[ecured]( https://www.ecured.cu/Alcohol%C3%ADmetro)
DE INTERÉS
Para más información relacionada con las áreas de ciencia, tecnología, ingeniería y matemáticas, no dudes en visitar #stemsocial y #stem-espanol, son comunidades que promueven avances científicos en estas áreas

No soy amante de la química pero es interesante ver la composición y transformación a través de la reacción química que originan a su vez productos, la formación de nuevas sustancias con características diferentes entre otros términos como reducción, oxidación me llevo algunos años atrás cuando estudie química en bachillerato, saludos es muy bueno ver qué en esta plataforma se promueve una educación compleja. 🌎
Gracias @edlili24, hay un lema que dice que la química esta en todo, pues es la absoluta verdad, desde los aspectos mas simples hasta los mas complejos esta presente esta ciencia, su compresión es sencilla lo ideal es buscar una buena estrategia para comprenderla... Saludos
¡Felicitaciones!
1. Invierte en el PROYECTO ENTROPÍA y recibe ganancias semanalmente. Entra aquí para más información.
3. Suscríbete a nuestra COMUNIDAD, apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
4. Creación de cuentas nuevas de Hive aquí.
5. Visita nuestro canal de Youtube.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias @entropia por tu apoyo y valoración positiva realizada en mis publicaciones . Saludos
Su post ha sido valorado por @ramonycajal
Gracias @ramonycajal por la valoración realizada a mi trabajo y agradecido por el apoyo a los autores que publicamos contenidos de carácter científico. Saludos
Congratulations @madridbg! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s) :
You can view your badges on your board and compare yourself to others in the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @hivebuzz:
Gracias @hivebuzz, por cada valoración positiva que realizas en mis publicaciones y en los logros que he ido adquiriendo en la comunidad. Saludos
De nada @madridbg 👍😉
¡Te agradeceríamos mucho que votaras por nuestra propuesta para que podamos seguir con el buen trabajo!
Muy buena la manera como explicas con detalle lo que ocurre en estos procesos quimicos y su aplicación práctica. Saludos
Gracias @popurri por tomarte el tiempo de leer el material posteado en mi blog y contento porque te haya gustado las aplicaciones que tiene la química como ciencia.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Thanks for including @stemsocial as a beneficiary, which gives you stronger support. Using the STEMsocial app could yield even more supporti next time.
Gracias @steemstem ,por el apoyo que demuestran día con día a los contenidos de carácter científico que se publican a través de https://stem.openhive.network/ y mediante la plataforma de hive.blog. Sin duda es un incentivo contar con sus apoyo. Gracias nuevamente y saludos...