
Autor: @madridbg, a través de Power Point 2010, utilizando imágenes de dominio público.
Saludos estimados miembros de la comunidad de #hive, continuando con la socialización de los contenidos de la química desde una utilidad práctica, en esta oportunidad estaremos abordando lo referente al comportamientos de los gases en función de la ley de Dalton y su influencia en un deporte como el buceo.
Como ha sido constante en mis publicación, este tipo de contenidos lo comparto a través de las comunidades @stemsocial, @stem-espanol y @cervantes quienes hace un trabajo extraordinario en lo referente a los aportes de temas relacionados con el área científica bajo una estructura flexible y dinámica de las investigaciones.
INTRODUCCIÓN
En la naturaleza podemos encontrar una gran variedad de sustancias que exhiben un comportamiento en función al estado de la materia que presente y que podemos clasificar como sustancias en estado sólido, líquido y gaseoso. En este sentido, nos centraremos en abordar lo referente al comportamiento que manifiestan las sustancias gaseosas, ya que como seres vivos estamos inmersos en concentraciones elevadas de estas, entre los que se encuentra el oxígeno (O2), el nitrógeno (N2) y otros que productos de la industrialización de las ciudades se han convertido en un foco de contaminación para nuestro planeta, como lo es el dióxido de carbono (CO2).

Fig. 2. Las moléculas gaseosas se adaptan al recipiente que los contengan. Autor: Shafin Al Asad Protic
El comportamiento de los gases se refleja en función a las variables presión y temperatura quienes son las que delimitan la actuación de la sustancia. Sin embargo, por adecuación práctica de estas líneas investigativas, nos centraremos en el abordaje de aquellas sustancias gaseosa bajo condiciones atmosféricas comunes, es decir, 1 atmósfera de presión y una temperatura de 25 °C.
Bajos las condiciones ya establecidas, las sustancias diatómicas como el oxígeno y el nitrógeno, son gases a temperatura ambiente, por otro lado, las sustancias poli-atómicas como el dióxido de carbono y el metano son gases que exhiben un comportamiento líquido a temperatura ambiente, sin embargo, al subir la temperatura se convierten en gas con mucha facilidad.
Como ha sido mencionados en otras publicaciones, los gases tienen la capacidad de:
1. Adoptar la forma del recipiente que lo contiene.
2. Al estar confinados se pueden mezclar uniformemente y en su totalidad.
3. Son los más comprensibles de los tres estados de la materia, debido a la separación que presenta las moléculas de estas sustancias y a las pocas fuerzas intermoleculares que exhiben.
En este sentido, mediante esta publicación abordaremos en comportamiento de mezclas de gases, mediante la ley de Dalton y su implementación y afecciones en el buceo, de igual forma haremos un recorrido por los diferentes fundamentos químicos que se aplican en este deporte.
LA PRESIÓN DE LOS GASES EN FUNCIÓN DE LA PRESIÓN ATMOSFÉRICA
La presión atmosférica, afecta a todo lo que nos rodea y los humanos actuamos como si no existiera este tipo de fuerza, lo cual es atribuible a la adaptación que hemos tenido sobre la misma, un ejemplo práctico para ejemplificar la presencia de la presión atmosférica, se aplica cuando ingerimos una bebida a través de un popote (pitillo), al momento de succionar extraemos el aire dentro del popote y el espacio vacío generado se llena con el líquido el cual sube siendo empujado por la presión que la atmósfera ejerce sobre la sustancia.

Fig. 3. La presión atmosférica es la responsable que el líquido fluya a través del popote, también conocido como pitillo. Autor: JapoDelMal
Los gases no escapan a esta realidad y a causa del constante movimiento cinético de las moléculas tienden a ejercen una presión sobre la superficie de los materiales con los cuales entran en contacto. Por consiguiente, si queremos determinar la presión generadas por los gases debemos hacer una correlación entre la fuerza aplicada por unidad de área de modo que nos permita enunciar conceptualmente la presión de las sustancias.
A nivel atmosférico, la presión depende de la fuerza gravitatoria de nuestro planeta, por consiguiente es de esperase que mientras más cercanos estemos al suelo mayor será la presión ejercida por la atmósfera, producto de una densidad mayor de las moléculas de aire presentes, de modo que la presión atmosférica es dependiente de la temperatura, el tipo de clima y el lugar donde nos encontremos. A nivel práctico o experimental este tipo de fuerza se mide con un instrumento llamado barómetro, el cual nos permite medir la presión que soporta una columna de mercurio a una altura de 760 milímetros y 0 °C sobre el nivel del mar.

Fig. 4. Equipo adaptado para medir la presión atmosférica. Autor: UTLA
Otro aspecto que debemos tener en cuenta, es que la presión atmosférica se da de forma vertical de arriba hacia abajo, sin embargo el aire por ser gaseoso y fluido tiende a ejercer interacción en todas las direcciones posibles, producto de las constantes colisiones que se generan entre las moléculas.
LAS PRESIONES PARCIALES DE LOS GASES DESDE LA LEY DE DALTON
El aire que consumimos en el proceso respiratorio, no es oxígeno puro en su totalidad, al contrario es una mezcla conformada por diferentes gases, donde cada uno de estas sustancias ejercen una presión parcial al entrar en contacto con un objeto. Partiendo de esa premisa en 1801, Dalton enuncio la ley de los gases, donde manifiesta:
“La presión total de una mezcla de gases es igual a la suma de las presiones que cada gas ejercería si estuviera solo.” [3]
Por consiguiente, mediar la presión independiente se convierte en un proceso mucho más complejos, debido a que el manómetro solo mide la presión total del sistema, en este sentido debemos recurrir al uso de la técnica de espectrometría de masa de modo que las señales emitidas nos permita predecir las cantidades de sustancias presentes y en consecuencia las fracciones molares de las mismas. En función a estas variables aplicamos la ecuación presentada por Dalton y determinamos la presión independiente de los gases presentes en la mezcla.
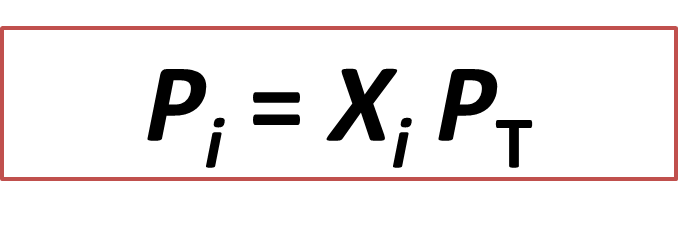
Ecuación 1: Representación de la ley de Dalton. Autor: @madridbg, a través de Power Point 2010, adaptado de: Chang, (2010).
Si analizamos la ecuación anterior nos damos cuenta, que se relaciona con la presión total (Pt) del sistema y con la fracción molar (Xi) de cada sustancia independiente, de modo que podamos determinar la presión parcial (Pi) de la sustancia que nos interesa.
COMPORTAMIENTO DE LOS GASES Y SU INCIDENCIA EN EL BUCEO
Gracias a las leyes de los gases el buceo se ha convertido en una actividad deportiva segura para aquellas personas entrenadas y con experiencia en el área, esto debido al desarrollo de equipos especializados con cierta autonomía asociadas a la respiración submarina, que controlan la cantidad y concentración de oxígeno y nitrógeno necesarios para una inmersión segura, de modo que se eviten daños fatales en el organismo producto de una expansión inadecuada de estas sustancias en nuestro interior.

Fig. 5. El buceo como deporte recreativo. Autor: PxHere
Por consiguiente, el funcionamiento y comportamiento de la presión en las profundidades del mar se atribuye con un aumento de esta variable a medida que la profundidad se incrementa, en este sentido, a una profundidad de 33 pies se estima una presión parcial de 1 atmósfera equivalente a la del aire, si esta profundidad se duplica, la presión también lo hace, por lo que podemos establecer que son directamente proporcionales. [1]

Fig. 6. Relación entre la profundiza y la presión generada. Autor: Hannes Grobe/AWI
Esta variación que se asume, es la responsable de los accidentes ocasionados cuando se practica el buceo sin las medidas adecuadas. Es necesario recordar que a mayor presión los gases se comprimen y cuando se realiza una subida acelerada a la superficie ocasiona que la mezcla de oxígeno y nitrógeno se vuelva menos densa y en este punto esta menos comprimida, de modo que ejerce mayor presión sobre las paredes de los pulmones ocasionando daños a esta.
Si la descompresión es muy alta, partes de las moléculas del gas se acumula en los capilares sanguíneos, evitando que llegue suficiente oxígeno al cerebro por lo que la persona exhibe un comportamiento denominado embolia por aire que en ocasiones provoca que las personas pierdan la conciencia antes de llegar a la superficie, este fenómeno puede ser reversible pero muy doloroso, para eso el buzo de pasar hora en una cámara de re-compresión cuyo objetivo es disminuir el tamaño de las moléculas del gas, hasta volverlas inocuas para el organismo.
Otro aspecto que debemos tomar en cuenta, es la composición de oxigeno que respiramos, el cual está en concentración 20 – 80 con el nitrógeno, es decir 20% es oxígeno y 80% es nitrógeno, por lo que podemos establecer que es una disolución gaseosa. En este sentido, cuando el buzo se sumerge la presión del agua sobre él es mayor a la presión atmosférica, por lo que nuestros órganos deben equilibrar y mantener una presión igual a la presión ejercida por el agua, para ello se ha desarrollado equipos especializados que cumplen con este cometido y los cuales van disminuyendo la cantidad de oxigeno que entra en nuestro cuerpo en función de la profundidad.
En otras palabras, si la presión ejercida por el agua es de 2 atmósferas, la cantidad de oxigeno que entra a nuestro organismo será de 10% un reajuste automático que realiza una válvula especial adaptada a los tanques de buceo.

Fig. 7. Relación entre la profundiza y la presión generada. Autor: Alexander Lesnitsky
APORTES DE LA TEMÁTICA
El abordaje de esta temática, nos permitió profundizar lo relacionado con las leyes de los gases desde la teoría de Dalton, así mismo, nos permitió comprender en comportamiento de estas sustancias en función de la presión atmosférica y como afectan estos principios la salud de las personas dedicadas al buceo como deporte recreativo.
BIBLIOGRAFÍA CONSULTADA
[1] Chang, R. (2010). Química. Decima edicion. McGraw-hill Interamericana editores. ISBN: 978-607-15-0307-7.
[2] Katz Miguel John Dalton y la Teoría Atómica. Epistemología e Historia de la Química – Curso 2011. Artículo: Acceso Online
[3] McMURRY E., John y Fay C., Robert. (2008). Química general. Quinta edición PEARSON EDUCACIÓN, México, 2009 ISBN: 978-970-26 1286-5.
[4] Ralph, H. Petrucci, William S. Harwood, E. Geoffrey Herring. (2003). QUIMICA GENERAL. Octava edición. PEARSON EDUCACIÓN. S.A., Madrid.
[5] WADE,LEROY. (2011). . QUÍMICA ORGÁNICA. VOLUMEN 2. SÉPTIMA EDICIÓN. PEARSON EDUCACIÓN, MÉXICO, 2011 ISBN: 978-607-32.()793•5. ÁREA: CIENCIAS
DE INTERÉS
________________________________________
Para más información relacionada con las áreas de ciencia, tecnología, ingeniería y matemáticas, no dudes en visitar #stemsocial y #stem-espanol, son comunidades que promueven avances científicos en estas áreas

#posh twitter
¡Felicitaciones!
Estás participando para optar a la mención especial que se efectuará el domingo 20 de diciembre del 2020 a las 8:00 pm (hora de Venezuela), gracias a la cual el autor del artículo seleccionado recibirá la cantidad de 1 HIVE transferida a su cuenta.
¡También has recibido 1 ENTROKEN! El token del PROYECTO ENTROPÍA impulsado por la plataforma Steem-Engine.
1. Invierte en el PROYECTO ENTROPÍA y recibe ganancias semanalmente. Entra aquí para más información.
2. Contáctanos en Discord: https://discord.gg/hkCjFeb
3. Suscríbete a nuestra COMUNIDAD y apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
4. Creación de cuentas nuevas de Hive aquí.
5. Visita nuestro canal de Youtube.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracia @entropia por el apoyo que demuestran en cada una de mis publicaciones.
Has sido votado por
PROYECTO ENLACE
'Conectando Ideas y Comunidades'
PROYECTO ENLACE es un proyecto de curación de habla hispana enfocado en recompensar contenido de calidad y apoyar autores en su proceso de crecimiento en HIVE.
Creemos y apostamos por el futuro de esta gran plataforma, y estamos muy emocionados de poder hacerla crecer junto a esta comunidad. Así que te invitamos a usar nuestra etiqueta ENLACE y estar atento a todas las actividades que tenemos preparadas y que estaremos publicando en breve.
Te invitamos a participar en nuestro servidor de Discord: https://discord.gg/3S9y7BbWfS
Atentamente
EQUIPO ENLACE 2020
Gracias @enlace por el apoyo sobre mi publicación.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.
Thank you @steemstem for the support and assessment you make in each of my publications, without a doubt they motivate me to continue working based on the growth within the community.
Su post ha sido valorado por @ramonycajal
Grateful for your support @ramonycajal, it allows me to continue promoting my growth within the platform #hive